Fluorid bromičný
| Fluorid bromičný | |
|---|---|
 Struktura fluoridu bromičného | |
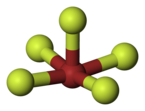 Kuličkový model fluoridu bromičného | |
| Obecné | |
| Systematický název | Fluorid bromičný |
| Anglický název | Bromine pentafluoride |
| Německý název | Brompentafluorid |
| Sumární vzorec | BrF5 |
| Vzhled | nažloutlá kapalina |
| Identifikace | |
| Registrační číslo CAS | 7789-30-2 |
| PubChem | 24606 |
| SMILES | FBr(F)(F)(F)F |
| InChI | InChI=1S/BrF5/c2-1(3,4,5)6 |
| Vlastnosti | |
| Molární hmotnost | 174,894 g/mol |
| Teplota tání | −61,30 °C |
| Teplota varu | 40,25 °C |
| Hustota | 2,466 g·cm−3 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Fluorid bromičný je interhalogen se vzorcem BrF5. Je to nažloutlá kapalina a silné fluorační činidlo.
Příprava
Poprvé byl připraven roku 1931 přímou reakcí bromu s fluorem.[2] Tato reakce je vhodná i pro přípravu větších množství, probíhá při teplotě 150 °C v nadbytku fluoru.
- Br2 + 5 F2 → 2 BrF5
Malá množství je možné připravit reakcí fluoru s bromidem draselným:[2]
- KBr + 3 F2 → KF + BrF5
Takto je možné připravit velice čistý BrF5, téměř beze stop BrF3 a dalších nečistot.[2]
Reakce
S vodou reaguje explozivně, ale v přítomnosti acetonitrilu probíhá hydrolýza pomaleji a vzniká kyselina bromičná a fluorovodíková:[3]
- BrF5 + 3 H2O → HBrO3 + HF
Má velmi silné fluorační účinky, za laboratorní teploty převádí většinu sloučenin uranu na fluorid uranový.
Může vystupovat i jako akceptor fluoridů, např. v reakci s CsF:[3]
- BrF5 + CsF → CsBrF6
Využití
Využívá se v izotopové analýze kyslíku, laserovou ablací pevných silikátů se v přítomnosti BrF5 uvolňuje kyslík, který je možné následně analyzovat.[4] Byl také testován jako oxidovadlo pro raketová paliva a využívá se jako fluorační činidlo při zpracování uranu.
Zdravotní rizika
Silně leptá kůži, jeho výpary dráždí oči, kůži a sliznice. Expozice 100 ppm po dobu několika minut je smrtelná pro většinu experimentálních zvířat. Chronická expozice může způsobit poškození ledvin a selhání jater.[5]
Kontakt s organickými sloučeninami nebo kovovým prachem může vést k vzplanutí nebo explozi.[5]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Bromine pentafluoride na anglické Wikipedii.
- ↑ a b Bromine pentafluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b c HYDE, Gene A.; BOUDAKIAN, Max M. Synthesis routes to chlorine and bromine pentafluorides. Inorganic Chemistry. 1968-12, roč. 7, čís. 12, s. 2648–2649. Dostupné online [cit. 2019-06-18]. ISSN 0020-1669. doi:10.1021/ic50070a039. (anglicky)
- ↑ a b GREENWOOD, NORMAN NEILL. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. ISBN 8085427389, ISBN 9788085427387. OCLC 320245801 S. 1027.
- ↑ CLAYTON, Robert N; MAYEDA, Toshiko K. The use of bromine pentafluoride in the extraction of oxygen from oxides and silicates for isotopic analysis. Geochimica et Cosmochimica Acta. 1963-1, roč. 27, čís. 1, s. 43–52. Dostupné online [cit. 2019-06-18]. doi:10.1016/0016-7037(63)90071-1. (anglicky)
- ↑ a b PATNAIK, PRADYOT. A comprehensive guide to the hazardous properties of chemical substances. 3rd ed. vyd. Hoboken, NJ: John Wiley xxiii, 1059 pages s. ISBN 9780471714583, ISBN 0471714585. OCLC 76871595 S. 480.
Externí odkazy
 Obrázky, zvuky či videa k tématu fluorid bromičný na Wikimedia Commons
Obrázky, zvuky či videa k tématu fluorid bromičný na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Autor: Д.Ильин: vectorization, Licence: CC0
Geometry and dimensions of bromine pentafluoride
Ball-and-stick model of the bromine pentafluoride molecule, BrF5
- Bromine, Br: redbrown
- Fluorine, F: green
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances











