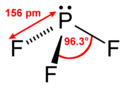Fluorid fosforitý
| Fluorid fosforitý | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Fluorid fosforitý |
| Anglický název | Phosphorus trifluoride |
| Německý název | Phosphorus trifluoride |
| Sumární vzorec | PF3 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 7783-55-3 |
| EC-no (EINECS/ELINCS/NLP) | 232-008-7 |
| PubChem | 62665 |
| ChEBI | CHEBI:30205 |
| SMILES | FP(F)F |
| InChI | InChI=1S/F3P/c1-4(2)3 Key: WKFBZNUBXWCCHG-UHFFFAOYSA-N |
| Číslo RTECS | TH3850000 |
| Vlastnosti | |
| Molární hmotnost | 87,968971 g/mol |
| Teplota tání | −151,5 °C (−240,7 °F; 121,6 K) |
| Teplota varu | −101,8 °C (−151,2 °F; 171,3 K) |
| Hustota | 3,91 g/dm3 |
| Rozpustnost ve vodě | ve vodě pomalu hydrolyzuje |
| Struktura | |
| Tvar molekuly | trojúhelníková pyramida |
| Dipólový moment | 1,03 D (3,4 · 10−30 C·m) |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −958,44 kJ/mol |
| Standardní molární entropie S° | 273,06 J/(mol·K) |
| Standardní slučovací Gibbsova energie ΔGf° | −898 kJ/mol |
| Měrné teplo | 59 J/(mol·K) |
| Bezpečnost | |
| H-věty | H280, H314, H330, H331 |
| P-věty | P260, P261, P264, P271, P280, P284, P301+330+331, P302+361+354, P304+340, P305+354+338, P316, P320, P321, P363, P403+233, P405, P410+403, P501 |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Fluorid fosforitý je anorganická sloučenina s chemickým vzorcem PF3.
Příprava
Fluorid fosforitý je obvykle připravován z chloridu fosforitého halogenovou výměnou za použití různých fluoridů, jako třeba fluorovodíku, fluoridu vápenatého, fluoridu arsenitého, fluoridu antimonitého nebo fluoridu zinečnatého:[1][2][3]
2 PCl3 + 3 ZnF2 → 2 PF3 + 3 ZnCl2
Vlastnosti
Vazebný úhel F-P-F ve fluoridu fosforitém je přibližně 96,3°. Plynný fluorid fosforitý má standardní slučovací entalpii −958,44 kJ/mol.[4] Atom fosforu má chemický posun nukleární magnetické rezonance 97 ppm.
Fluorid fosforitý hydrolyzuje zejména při vyšším pH, ale je méně hydrolyticky citlivý než chlorid fosforitý. Fluorid fosforitý nepůsobí na sklo s výjimkou vysokých teplot. K sušení lze s malými ztrátami využít bezvodý hydroxid draselný. S horkými kovy tvoří fosfidy a fluoridy. S Lewisovými zásadami, jako například amoniak, tvoří adukty a fluorid fosforitý je oxidován oxidačními činidly, jako je brom nebo manganistan draselný.
Jako ligand přechodných kovů, je fluorid fosforitý silný π-akceptor.[5] Fluorid fosforitý tvoří řadu komplexů s kovy o nízkých oxidačních stavech. Fluorid fosforitý tvoří několik komplexů, pro které odpovídající karbonyly kovů neexistují nebo jsou nestabilní. Například Pd(PF3)4 je známý, ale Pd(CO)4 nikoliv.[6][7][8] Takové komplexy jsou obvykle připravovány přímo z příbuzné karbonylové sloučeniny ztrátou oxidu uhelnatého. Avšak kovový nikl reaguje přímo s fluoridem fosforitým při 100 °C za tlaku 35 MPa za vzniku Ni(PF3)4, který je analogický k Ni(CO)4. Cr(PF3)6, analog Cr(CO)6, lze připravit z bis(benzen)chromu:
- Cr(C6H6)2 + 6 PF3 → Cr(PF3)6 + 2 C6H6
 |  |
| Kuličkový model [Pt(PF3)4] | Kalotový model [Pt(PF3)4] |
Využití
Fluorid fosforitý není využíván ve velkém měřítku. Ve výzkumu se však využívá při organické syntéze a přípravě komplexů.
Biologická aktivita
Fluorid fosforitý se podobá oxidu uhelnatému, protože se silně váže na železo v hemoglobinu, čímž brání krvi absorbovat kyslík.[9]
Bezpečnost
Fluorid fosforitý je vysoce toxický, srovnatelně s fosgenem.[10]
Odkazy
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid fosforitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid fosforitý na Wikimedia Commons
Reference
V tomto článku byly použity překlady textů z článků Phosphorus trifluoride na anglické Wikipedii a Phosphor(III)-fluorid na německé Wikipedii.
- ↑ WILLIAMS, A. A.; PARRY, Robert W.; DESS, Howard. Phosphorus(III) Fluoride. Příprava vydání Therald Moeller. 1. vyd. Svazek 5. [s.l.]: Wiley Dostupné online. ISBN 978-0-470-13164-0, ISBN 978-0-470-13236-4. DOI 10.1002/9780470132364.ch26. S. 95–97. (anglicky) DOI: 10.1002/9780470132364.ch26.
- ↑ DUBRISAY, René; PASCAL, Paul. Nouveau traité de chimie minérale: Azote, phosphore. [s.l.]: Masson et Cie 963 s. Dostupné online. ISBN 978-2-225-57123-7. (francouzsky)
- ↑ CLARK, Ronald J.; BELEFANT, Helen; WILLIAMSON, Stanley M. Phosphorus Trifluoride. Příprava vydání Robert J. Angelici. 1. vyd. Svazek 28. [s.l.]: Wiley Dostupné online. ISBN 978-0-471-52619-3, ISBN 978-0-470-13259-3. DOI 10.1002/9780470132593.ch77. S. 310–315. (anglicky)
- ↑ CHASE, M. W. NIST-JANAF Thermochemical Tables, 4th Edition. NIST. 1998-08-01. (anglicky)
- ↑ GREENWOOD. Chemistry of the Elements. [s.l.]: Elsevier Science & Technology Books book s. Dostupné online. ISBN 978-0-08-037941-8. S. 494. (anglicky)
- ↑ NICHOLLS, David. Complexes and First-Row Transition Elements. SpringerLink. 1974. Dostupné online [cit. 2023-09-02]. DOI 10.1007/978-1-349-02335-6. (anglicky)
- ↑ KRUCK, Th. Trifluorphosphin-Komplexe von Übergangsmetallen. Angewandte Chemie. 1967-01-07, roč. 79, čís. 1, s. 27–43. Dostupné online [cit. 2023-09-02]. DOI 10.1002/ange.19670790104. (německy)
- ↑ CLARK, Ronald J.; BUSCH, Marianna A. Stereochemical studies of metal carbonylphosphorus trifluoride complexes. Accounts of Chemical Research. 1973-07-01, roč. 6, čís. 7, s. 246–252. Dostupné online [cit. 2023-09-02]. ISSN 0001-4842. DOI 10.1021/ar50067a005. (anglicky)
- ↑ WILKINSON, Geoffrey. Phosphorus Trifluoride–Hæmoglobin. Nature. 1951-09, roč. 168, čís. 4273, s. 514–514. Dostupné online [cit. 2023-08-31]. ISSN 1476-4687. DOI 10.1038/168514a0. (anglicky)
- ↑ GREENWOOD. Chemistry of the Elements. [s.l.]: Elsevier Science & Technology Books book s. Dostupné online. ISBN 978-0-08-037941-8. (anglicky)
Média použitá na této stránce
Ball-and-stick model of the tetrakis(trifluorophosphine)platinum(0) molecule, [Pt(PF3)4].
X-ray crystallographic data from Chem. Eur. J. (2008) 14, 4280-4286.
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.Space-filling model of the tetrakis(trifluorophosphine)platinum(0) molecule, [Pt(PF3)4].
X-ray crystallographic data from Chem. Eur. J. (2008) 14, 4280-4286.
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gases under pressure
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.