Fluorid hafničitý
| Fluorid hafničitý | |
|---|---|
 | |
| Obecné | |
| Systematický název | Fluorid hafničitý |
| Anglický název | Hafnium tetrafluoride |
| Německý název | Hafnium(IV)-fluorid |
| Sumární vzorec | HfF4 |
| Vzhled | bílé krystaly |
| Identifikace | |
| Registrační číslo CAS | 13709-52-9 |
| EC-no (EINECS/ELINCS/NLP) | 237-258-0 |
| PubChem | 4092293 |
| SMILES | [F-].[F-].[F-].[F-].[Hf+4] |
| InChI | InChI=1S/4FH.Hf/h4*1H;/q;;;;+4/p-4 Key: QHEDSQMUHIMDOL-UHFFFAOYSA-J |
| Vlastnosti | |
| Molární hmotnost | 254,48 g/mol |
| Teplota tání | 762 °C |
| Teplota varu | 970 °C (sublimuje) |
| Hustota | 7,1 g/cm3 |
| Rozpustnost ve vodě | rozkládá se |
| Struktura | |
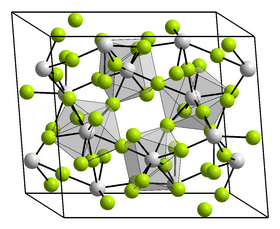
| Krystalová struktura | jednoklonná |
| Hrana krystalové mřížky | a = 1172,5 pm, b = 986,9 pm, c = 763,6 pm |
| Bezpečnost | |
| H-věty | H315, H318, H331, H335 |
| P-věty | P261, P264, P264+265, P271, P280, P302+352, P304+340, P305+354+338, P316, P317, P319, P321, P332+317, P362+364, P403+233, P405, P501 |
Některá data mohou pocházet z datové položky. | |
Fluorid hafničitý je anorganická sloučenina s chemickým vzorcem HfF4.
Příprava
Fluorid hafničitý lze připravit reakcí oxidu hafničitého s fluorem:[1]
- HfO2 + 2 F2 → HfF4 + O2
Lze jej také získat fluorací hafnia, karbidu hafničitého nebo boridu hafničitého.[2]
Vlastnosti
Fluorid hafničitý je bílá pevná látka[3], která krystalizuje v jednoklonné krystalové soustavě typu fluoridu zirkoničitého s prostorovou grupou C2/c (Číslo 15) a parametry mřížky a = 1172,5 pm, b = 986,9 pm, c = 763,6 pm a β = 126,15°.[4] Je znám také trihydrát fluoridu hafničitého.[5] Sloučenina reaguje s kyselinou fluorovodíkovou za vzniku různých hydrátů (mono- a trihydrátu) a oxyfluoridů.[6]
Reference
V tomto článku byly použity překlady textů z článků Hafnium tetrafluoride na anglické Wikipedii a Hafnium(IV)-fluorid na německé Wikipedii.
- ↑ TOUMANOV, I. N. Plasma and High Frequency Processes for Obtaining and Processing Materials in the Nuclear Fuel Cycle. [s.l.]: Nova Publishers 628 s. Dostupné online. ISBN 978-1-59033-009-8. S. 104. (anglicky)
- ↑ HAGEN, A. P. Inorganic Reactions and Methods, The Formation of Bonds to Halogens (Part 2). [s.l.]: John Wiley & Sons 526 s. Dostupné online. ISBN 978-0-470-14539-5. S. 288. (anglicky)
- ↑ BEZPEČNOSTNÍ LIST Hafnium(IV) fluoride, 99.9% (metals basis) [online]. Thermo Scientific Chemicals [cit. 2023-11-03]. Dostupné online. Dostupné také na: [1].
- ↑ BENNER, G.; MÜLLER, B. G. Zur Kenntnis binärer Fluoride des ZrF 4 ‐Typs: HfF 4 und ThF 4. Zeitschrift für anorganische und allgemeine Chemie. 1990-09, roč. 588, čís. 1, s. 33–42. Dostupné online [cit. 2023-11-03]. ISSN 0044-2313. DOI 10.1002/zaac.19905880105. (anglicky)
- ↑ JOHNSON, B. F. G. Inorganic Chemistry of the Transition Elements: Volume 1. [s.l.]: Royal Society of Chemistry 433 s. Dostupné online. ISBN 978-0-85186-500-3. S. 22. (anglicky)
- ↑ CLARK, R. J. H.; BRADLEY, D. C.; THORNTON, P. The Chemistry of Titanium, Zirconium and Hafnium: Pergamon Texts in Inorganic Chemistry. [s.l.]: Elsevier 151 s. Dostupné online. ISBN 978-1-4831-5921-8. S. 33. (anglicky) Google-Books-ID: 1AJPDAAAQBAJ.
Média použitá na této stránce
Autor: Orci, Licence: CC BY-SA 3.0
Crystal structure of Uranium tetrafluoride
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances






