Fluorid hlinitý
| Fluorid hlinitý | |
|---|---|
 3D model polyedru | |
 vzorec | |
 3D model | |
| Obecné | |
| Systematický název | Fluorid hlinitý Trifluoralan |
| Anglický název | Aluminium fluoride |
| Německý název | Aluminiumfluorid |
| Sumární vzorec | AlF3 |
| Vzhled | bílý prášek nebo krystalky |
| Identifikace | |
| Registrační číslo CAS | 7784-18-1 |
| 32287-65-3 (monohydrát) 15098-87-0 (trihydrát) | |
| PubChem | 2124 |
| ChEBI | 49464 |
| Číslo RTECS | BD0725000 |
| Vlastnosti | |
| Molární hmotnost | 83,976 7 g/mol 101,022 g/mol (monohydrát) 138,023 g/mol (trihydrát) |
| Teplota sublimace | 1 280 °C |
| Hustota | 3,07 g/cm³ (0 °C) |
| Rozpustnost ve vodě | 0,13 g/100 g (0 °C) 0,28 g/100 g (10 °C) 0,50 g/100 g (25 °C) 0,69 g/100 g (50 °C) 0,98 g/100 g (75 °C) 1,67 g/100 g (100 °C) |
| Rozpustnost v polárních rozpouštědlech | roztoky fluoridů kapalný fluorovodík |
| Struktura | |
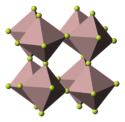
| Krystalová struktura | šesterečná |
| Hrana krystalové mřížky | a= 492 pm c= 625 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −1 510 kJ/mol |
| Entalpie rozpouštění ΔHrozp | −164,3 J/g |
| Entalpie sublimace ΔHsub | 3 240 J/g |
| Standardní molární entropie S° | 66,48 J K−1 mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −1 431 kJ/mol |
| Izobarické měrné teplo cp | 0,894 J K−1 g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R22, R36/37/38 |
| S-věty | S26 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Fluorid hlinitý (chemický vzorec AlF3) je anorganická sloučenina primárně používaná ve výrobě hliníku. Může být připraven synteticky, ale vyskytuje se i v přírodě.
Výskyt a výroba
Nejvíce používaný postup pro výrobu fluoridu hlinitého reakcí oxidu hlinitého Al2O3 a kyselinou hexafluorokřemičitou H2SiF6:
- H2SiF6 + Al2O3 → 2 AlF3 + SiO2 + H2O
Druhý způsob je pomocí tepelného rozkladu hexafluorohlinitanu ammoného (NH4)3AlF6. Menší množství je také možné připravit pomocí reakce hydroxidu hlinitého Al(OH)3 (popř. samotného hliníku) s kyselinou fluorovodíkovou HF.
Trihydrát fluoridu hlinitého se nachází v přírodě jako vzácný minerál rosenbergit.
Využití
Fluorid hlinitý je důležité aditivum při výrobě hliníku pomocí elektrolýzy. Společně s kryolitem snižují bod tání pod 1 000 °C a zvyšují vodivost elektrolytu.
Mimo jiné je využívaný (společně s fluoridem zirkoničitým ZrF4) pro výrobu fluorohlinitého skla, které se využívá na výrobu optických vláken.
Využívá se k zabránění kvašení.
Zdravotní rizika
Po požití může dojít k poškození trávicího traktu, jater a ledvin. Znakem otravy jsou bolesti břicha, zvracení a průjem. Při požití většího množství i křeče.
Reference
V tomto článku byl použit překlad textu z článku Aluminium fluoride na anglické Wikipedii.
- ↑ a b Aluminum fluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid hlinitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid hlinitý na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Aluminium-trifluoride-monomer-2D-dimensions