Fluorid kobaltitý
| fluorid kobaltitý | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Fluorid kobaltitý |
| Anglický název | Cobalt(III) fluoride |
| Německý název | Cobalt(III)-fluorid |
| Sumární vzorec | CoF3 |
| Vzhled | hnědý prášek |
| Identifikace | |
| Registrační číslo CAS | 10026-18-3 |
| EC-no (EINECS/ELINCS/NLP) | 233-062-4 |
| PubChem | 66208 |
| SMILES | F[Co](F)F |
| InChI | InChI=1S/Co.3FH/h;3*1H/q+3;;;/p-3 Key: WZJQNLGQTOCWDS-UHFFFAOYSA-K |
| Vlastnosti | |
| Molární hmotnost | 115,928 g/mol |
| Teplota tání | 927 °C (1701 °F; 1200 K) |
| Hustota | 3,88 g/cm3 |
| Rozpustnost ve vodě | s vodou reaguje |
| Struktura | |
| Krystalová struktura | hexagonální |
| Hrana krystalové mřížky | a = 527,9 pm |
| Tvar molekuly | oktaedr |
| Bezpečnost | |
| H-věty | H301, H314, H317 |
| P-věty | P260, P261, P264, P270, P272, P280, P301+330+331, P302+352, P304+340, P321, P330, P363, P405, P301+316, P302+361+354, P316, P305+354+338, P362+364, P333+317 |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Fluorid kobaltitý je anorganická sloučenina s chemickým vzorcem CoF3.
Příprava
Fluorid kobaltitý lze připravit reakcí chloridu kobaltnatého s fluorem při 250 °C:[1][2]
- 2 CoCl2 + 3 F2 → 2 CoF3 + 2 Cl2
V této redoxní reakci je Co2+ oxidován na Co3+ a Cl− na Cl2, zatímco F2 je redukován na F−. Pomocí reakce oxidu kobaltnatého nebo fluoridu kobaltnatého s fluorem můžeme také připravit fluorid kobaltitý.[1] Fluorid kobaltitý může být také připraven reakcí chloridu kobaltnatého s fluoridem chloritým a nebo fluoridem bromitým.[1]
Reakce
Fluorid kobaltitý se rozkládá při styku s vodou za vzniku kyslíku:[3]
Fluorid kobaltitý reaguje s fluoridy za vzniku aniontu o složení [CoF6]3−, kobaltitý ion v tomto komplexu má vysokospinovou konfiguraci.
Vlastnosti
Fluorid kobaltitý je světle hnědý prášek, který na vzduchu okamžitě ztmavne. Proto se čistý fluorid kobaltitý skladuje ve vzduchotěsných nádobách ze skla, křemene nebo kovu. V proudu plynného fluoru při 600–700 °C se vypařuje a následně se rozkládá na fluorid kobaltnatý a fluor. Vyskytuje se také ve formě hydrátu, konkrétně dihydrátu.
Struktura
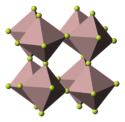
Bezvodý fluorid kobaltitý
Bezvodý fluorid kobaltitý krystalizuje v hexagonální krystalové struktuře, typu fluoridu hlinitého s a = 527.9 pm, α = 56.97°. Každý atom kobaltu je navázán k šesti atomům fluoru tvaru oktaedru s délkou vazby Co–F 189 pm.[1]
Hydrát fluoridu kobaltitého
Hydrát o složení CoF3·3,5H2O je známý. Předpokládá se že přesnější je popis jako [CoF3(H2O)3]·0,5H2O.[1]
Existuje zpráva o hydrátu CoF3·3,5H2O izomorfního k AlF3·3H2O.[1]
Plynný fluorid kobaltitý
V plynném skupenství by měl být fluorid kobaltitý planární.
Využití
Fluorid kobaltitý je silné fluorační činidlo. Fluorid kobaltitý se používá k fluoraci uhlovodíků na perfluoruhlovodíky:
- 2 CoF3 + R-H → 2 CoF2 + R-F + HF
Fluorid kobaltnatý je vedlejším produktem.
Tyto reakce jsou někdy doprovázeny přeskupováním nebo jinými reakcemi.[4] Příbuzné činidlo KCoF4 je selektivnější.[5]
Odkazy
Reference
V tomto článku byly použity překlady textů z článků Cobalt(III) fluoride na anglické Wikipedii a Cobalt(III)-fluorid na německé Wikipedii.
- ↑ a b c d e f LEVASON, W.; MCAULIFFE, C.A. Higher oxidation state chemistry of iron, cobalt, and nickel.. Coordination Chemistry Reviews. 1974-04, roč. 12, čís. 2, s. 151–184. Dostupné online [cit. 2023-10-12]. DOI 10.1016/S0010-8545(00)82026-3. (anglicky)
- ↑ PRIEST, Homer F.; SWINEHERT, Carl F. Anhydrous Metal Fluorides. Inorganic Syntheses. 1950-01, s. 171–183. Dostupné online [cit. 2023-10-12]. ISSN 1934-4716. DOI 10.1002/9780470132340.ch47.
- ↑ BRAUER, Georg. Handbuch der präparativen anorganischen Chemie. [s.l.]: F. Enke 626 s. Dostupné online. ISBN 978-3-432-02328-1. S. 276. (německy)
- ↑ COE, Paul L. Cobalt(III) Fluoride. Příprava vydání John Wiley & Sons, Ltd. Chichester, UK: John Wiley & Sons, Ltd Dostupné online. ISBN 978-0-471-93623-7, ISBN 978-0-470-84289-8. DOI 10.1002/047084289x.rc185. (anglicky)
- ↑ COE, Paul L. Potassium Tetrafluorocobaltate(III). Příprava vydání John Wiley & Sons, Ltd. Chichester, UK: John Wiley & Sons, Ltd Dostupné online. ISBN 978-0-471-93623-7, ISBN 978-0-470-84289-8. DOI 10.1002/047084289x.rp251. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu fluorid kobaltitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu fluorid kobaltitý na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.