Fluorid kryptonatý
| Fluorid kryptonatý | |
|---|---|
 Strukturní vzorec | |
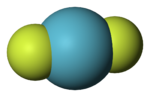 Model molekuly | |
| Obecné | |
| Systematický název | fluorid kryptonatý |
| Sumární vzorec | KrF2 |
| Vzhled | bílá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 13773-81-4 |
| PubChem | 83721 |
| SMILES | F[Kr]F |
| InChI | 1S/KrF2/c1-3-2 |
| Vlastnosti | |
| Molární hmotnost | 121,79 g/mol |
Některá data mohou pocházet z datové položky. | |
Fluorid kryptonatý (KrF2) je anorganická sloučenina složená z kryptonu a fluoru. Jedná se o první popsanou sloučeninu kryptonu.[1] Za standardních podmínek to je bezbarvá těkavá pevná látka. Molekula KrF2 je lineární, délka vazby Kr−F činí 188,9 pm. KrF2 reaguje se silnými Lewisovými kyselinami za vzniku solí kationtů KrF+ a Kr
2 F +
3 .[2]
Atomizační energie KrF2 (KrF2(g) → Kr(g) + 2F(g)) je 91,7 kJ/mol a průměrná energie vazby Kr–F pouze 46 kJ/mol,[3] což je nejmenší známá hodnota u jakéhokoliv izolovatelného fluoridu; v molekule fluoru (F2) je energie vazby přibližně 150 kJ/mol. KrF2 je tak dobrým zdrojem vysoce reaktivního a oxidujícího atomárního fluoru. Je tepelně nestabilní, při pokojové teplotě se za hodinu rozloží asi z 10 %.[4]
Fluorid kryptonatý je endotermní sloučenina, jeho slučovací teplo má při 93 °C hodnotu 60±3 kJ/mol.[4]
Příprava
Fluorid kryptonatý lze připravit mnoha způsoby, mezi ně patří elektrický výboj, fotoionizace, použití horkého drátu a bombardování protony. Produkt lze skladovat při −78 °C aniž by se rozkládal.[5]
Elektrický výboj
Využití elektrického výboje bylo první metodou použitou k přípravě fluoridu kryptonatého a též při jediném experimentu, při kterém byl oznámen vznik fluoridu kryptoničitého, jehož identifikace však byla později zpochybněna. Při této metodě se používá směs F2 a Kr v poměru 1:1 až 2:1 za tlaku 5 až 8 kPa, kdy je mezi elektrodami dostatek energie. Lze dosáhnout rychlosti tvorby KrF2 až okolo 0,25 g/h. Nevýhodou tohoto postupu je nízká výtěžnost.[2][6]
Bombardování protony
Příprava KrF2 pomocí protonového bombardování může probíhat rychlostí až přibližně 1 g/h. Provádí se bombardováním směsi Kr a F2 svazkem protonů s energiemi 10 MeV při teplotě okolo 133 K. Jedná se o rychlý způsob získání poměrně velkých množství KrF2, ovšem je při něm nutný zdroj částic α, obvykle cyklotron.[2][7]
Fotochemická reakce
Fotochemickou syntézu fluoridu kryptonatého popsala Lucia V. Streng v roce 1963 a poté v roce 1975 J. Slivnik.[8][9][2] Fotochemický proces přípravy KrF2 využívá ultrafialové záření a za dobrých podmínek lze pomocí něj dosáhnout rychlosti 1,22 g/h. Nejvhodnější vlnové délky jsou od 303 do 313 nm. Tvrdší ultrafialové záření podukci snižuje. Reakce probíhá nejlépe za podmínek, kdy je krypton pevná látka a fluor kapalina, čemuž odpovídá 77 K. Tento postup má nevýhodu v podobě nutnosti skladování kapalného F2 a jeho možného úniku při příliš vysokých tlacích.[2][6]
Horký drát
Příprava fluoridu kryptonatého pomocí horkého drátu využívá pevný krypton a horký drát umístěný několik centimetrů od něj; plynný fluor proudí kolem drátu. Tímto drátem probíhá velký elektrický proud, který jej zahřívá na přibližně 680 °C, což způsobuje tvorbu fluorových radikálů, které poté reagují s kryptonem. Za vhodných podmínek lze takto získat až 6 g/h. K dosažení co nejvyšší výtěžnosti by vzdálenost drátu od pevného kryptonu měla být 1 cm, kdy se vytvoří teplotní gradient o hodnotě okolo 900 °C/cm. Hlavní nevýhodou tohoto postupu je velké množství elektrického proudu, které musí projít drátem. Při nedostatečném zajištění může být tento postup nebezpečný.[2][6]
Struktura

Fluorid kryptonatý má dvě krystalické podoby: fázi α a fázi β. β-KrF2 se vyskytuje při teplotách nad −80 °C a α-KrF2 je stabilnější pod touto mezí.[2] Elementární buňka α-KrF2 je tetragonální.
Chemické vlastnosti
Fluorid kryptonatý je silné oxidační a fluorační činidlo, například oxiduje zlato do nejvyššího u tohoto prvku známého oxidačního čísla +5. Je dokonce silnější než elementární fluor, protože vazba Kr–F má menší energii než F–F; redoxní potenciál reakce reakce KrF2/Kr je +3,5 V, díky čemuž je fluorid kryptonatý nejsilnějším známým fluoračním činidlem, i když se předpokládá že KrF4 by měl být silnější:[10]
- 7 KrF2 (g) + 2 Au (s) → 2 KrF+AuF −
6 (s) + 5 Kr (g)
KrF+AuF −
6 se při teplotě 60 °C rozkládá na fluorid zlatičný, krypton a fluor:[11]
- KrF+AuF −
6 → AuF5 (s) + Kr (g) + F2 (g)
KrF2 může také oxidovat xenon na fluorid xenonový:[10]
- 3 KrF2 + Xe → XeF6 + 3 Kr
KrF2 lze použít na přípravu kationtu BrF +
6 .[5] KrF2 reaguje s SbF5 za tvorby soli KrF+SbF −
6 ; kation KrF+ dokáže zoxidovat BrF5 na BrF +
6 a ClF5 na ClF +
6 .[12]
KrF2 oxiduje stříbro do oxidačního stavu +3, reakcí s elementárním stříbrem nebo s fluoridem stříbrným (AgF) vzniká AgF3.[13][14]
Působením záření gama na krystalický fluorid kryptonatý při 77 K se tvoří fialově zbarvený radikál KrF•, jenž byl identifikován pomocí spektroskopie elektronové spinové rezonance. Radikál zachycený v krystalové mřížce má při 77 K, ovšem při 120 K se rozkládá.[15]
Reference
V tomto článku byl použit překlad textu z článku Krypton difluoride na anglické Wikipedii.
- ↑ A. V. Grosse; A. D. Kirshenbaum; A. G. Streng; L. V. Streng. Krypton Tetrafluoride: Preparation and Some Properties. Science. 1963, s. 1047–1048. DOI 10.1126/science.139.3559.1047. PMID 17812982. Bibcode 1963Sci...139.1047G.
- ↑ a b c d e f g J. Lehmann. The chemistry of krypton. Coordination Chemistry Reviews. 2002-11-01, s. 233–234. DOI 10.1016/S0010-8545(02)00202-3.
- ↑ Hodnoty De(F–KrF) a De(F–Kr•) by měly být podobné, přibližně 42 až 50 kJ/mol, přičemž hodnota ΔH(KrF+ → Kr+ + F•) se odhaduje na 176 kJ/mol.
- ↑ a b A. H. Cockett; K. C. Smith; Neil Bartlett. The Chemistry of the Monatomic Gases: Pergamon Texts in Inorganic Chemistry. [s.l.]: Pergamon Press, 1973. ISBN 978-0-08-018782-2.
- ↑ a b Šablona:Holleman&Wiberg
- ↑ a b c S. A. Kinkead; J. R. Fitzpatrick; J. Foropoulos; R. J. Kissane; D. Purson. Inorganic Fluorine Chemistry: Toward the 21st Century. [s.l.]: American Chemical Society, 1994. ISBN 978-0-8412-2869-6. DOI 10.1021/bk-1994-0555.ch003. Kapitola 3. Photochemical and thermal Dissociation Synthesis of Krypton Difluoride, s. 40–54.
- ↑ D. R. MacKenzie; J. Fajer. Synthesis of Noble Gas Compounds by Proton Bombardment. Inorganic Chemistry. 1966, s. 699–700. DOI 10.1021/ic50038a048.
- ↑ Ruren Xu; Wenqin Pang; Qisheng Huo. Modern Inorganic Synthetic Chemistry. Burlington: Elsevier Science, 2010. ISBN 9780444536006. DOI 10.1021/bk-1994-0555.ch003. S. 54.
- ↑ JAFFE, Mark. Lucia V. Streng, 85; Innovative Chemist At Temple University. The Philadelphia Inquirer. April 30, 1995. Dostupné v archivu pořízeném z originálu dne 16 March 2016. (anglicky)
- ↑ a b W. Henderson. Main group chemistry. Great Britain: Royal Society of Chemistry, 2000. Dostupné online. ISBN 0-85404-617-8. S. 149.
- ↑ Charlie Harding; David Arthur Johnson; Rob Janes. Elements of the p block. Great Britain: Royal Society of Chemistry, 2002. Dostupné online. ISBN 0-85404-690-9. S. 94.
- ↑ John H. Holloway; Eric G. Hope. Advances in Inorganic Chemistry. [s.l.]: Academic Press, 1998. Dostupné online. ISBN 0-12-023646-X. S. 60–61.
- ↑ A. Earnshaw; Norman Greenwood. Chemistry of the Elements. [s.l.]: Elsevier, 1997. ISBN 9780080501093. S. 903.
- ↑ Roland Bougon. Synthesis and properties of silver trifluoride AgF3. Inorganic Chemistry. 1984, s. 3667–3668. DOI 10.1021/ic00190a049.
- ↑ Falconer; J. R. Morton; A. G. Streng. Electron Spin Resonance Spectrum of KrF. The Journal of Chemical Physics. 1964-08-01, s. 902–903. ISSN 0021-9606. DOI 10.1063/1.1725990. Bibcode 1964JChPh..41..902F.
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid kryptonatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid kryptonatý na Wikimedia Commons
Média použitá na této stránce
Autor: Materialscientist, Licence: CC BY-SA 3.0
Crystal structure of krypton difluoride (KrF2). R. D. Burbank, W. E. Falconer and W. A. Sunder (1972). "Crystal Structure of Krypton Difluoride at -80°C". science 178 (4067): 1285-1286. DOI:10.1126/science.178.4067.1285.
Space-filling model of the krypton difluoride molecule (KrF2).
Colour code:
- Krypton, C: light blue
- Fluorine, H: lime-green


