Fluorid měďnatý
| Fluorid měďnatý | |
|---|---|
 Krystalická mřížka | |
 Krystalky (pevný) CuF2 | |
| Obecné | |
| Systematický název | Fluorid měďnatý |
| Anglický název | Copper(II) fluoride |
| Německý název | Kupfer(II)-fluorid |
| Sumární vzorec | CuF2 |
| Vzhled | bílý prášek (bezvodý) světlemodré krystalky (dihydrát) |
| Identifikace | |
| Registrační číslo CAS | 7789-19-7 |
| 13454-88-1 (dihydrát) | |
| PubChem | 82236 |
| Vlastnosti | |
| Molární hmotnost | 101,542 g/mol 137,573 g/mol (dihydrát) |
| Teplota tání | 950 °C (rozklad) |
| Hustota | 4,23 g/cm3 2,934 g/cm3 (dihydrát) |
| Rozpustnost ve vodě | 4,7 g/100 g (20 °C) 4,9 g/100 g (20 °C, dihydrát) |
| Rozpustnost v polárních rozpouštědlech | kyseliny dihydrát kyseliny ethanol methanol |
| Měrná magnetická susceptibilita | 125,664×10−6 cm3g−1 142,63×10−6 cm3g−1 (dihydrát) |
| Struktura | |
| Krystalová struktura | krychlová jednoklonná (dihydrát) |
| Hrana krystalové mřížky | a= 540,6 pm (krychlová) |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −551,8 kJ/mol −1 145,8 kJ/mol (dihydrát) |
| Entalpie tání ΔHt | 384 J/g |
| Standardní molární entropie S° | 68,6 J K−1 mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −491,9 kJ/mol −981,3 kJ/mol (dihydrát) |
| Izobarické měrné teplo cp | 0,692 J K−1 g−1 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Fluorid měďnatý (chemický vzorec CuF2) je v bezvodém stavu bílý prášek a v podobě dihydrátu tvoří světlemodré krystalky. Je nerozpustný v roztoku amoniaku, poměrně málo ve vodě, lépe však v roztocích kyselin, kde dochází ke vzniku komplexních sloučenin, dihydrát je navíc rozpustný v methanolu a ethanolu.
Reakce
Fluorid měďnatý lze připravit přímou syntézou z prvků, tedy mědi a fluoru, při teplotě 400 °C.
- Cu + F2 → CuF2
Při roztavení dochází k rozkladu, uvolňuje se fluor a vzniká fluorid měďný. Je na to potřeba teplotu 950 °C a vyšší.
- 2CuF2 → 2CuF + F2
Komplexní anionty CuF3−, CuF42− a CuF64− se vytváří, pokud je CuF2 vystaven jiné látce obsahující fluoridové anionty F−.
Využití
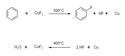
Aromatické uhlovodíky reagují s fluoridem měďnatým v kyslíkaté atmosféře při teplotách nad 450 °C za vzniku fluorovaných uhlovodíků. Tato reakce je jednodušší než Sandmeyerova reakce, ale je možná pouze pro sloučeniny, které jsou dostatečně stabilní, aby nedošlo k rozkladu při vysokých teplotách.
Reference
V tomto článku byl použit překlad textu z článku Copper(II) fluoride na anglické Wikipedii.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid měďnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid měďnatý na Wikimedia Commons
Média použitá na této stránce
created myself
Ball-and-stick model of the unit cell of copper(II) fluoride, CuF2
Fluorid měďnatý - CuF2