Fluorid manganatý
| Fluorid manganatý | |
|---|---|
 | |
| Obecné | |
| Systematický název | Fluorid manganatý |
| Anglický název | Manganese(II) fluoride |
| Německý název | Mangan(II)-fluorid |
| Sumární vzorec | MnF2 |
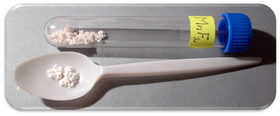
| Vzhled | světle růžové krystaly |
| Identifikace | |
| Registrační číslo CAS | 7782-64-1 |
| EC-no (EINECS/ELINCS/NLP) | 231-960-0 |
| PubChem | 24528 |
| SMILES | F[Mn]F |
| InChI | InChI=1/2FH.Mn/h2*1H;/q;;+2/p-2 Key: CTNMMTCXUUFYAP-NUQVWONBAJ |
| Číslo RTECS | OP0875000 |
| Vlastnosti | |
| Molární hmotnost | 92,934855 g/mol |
| Teplota tání | 856 °C (1,573 °F; 1,129 K) |
| Teplota varu | 1,820 °C (3,310 °F; 2,090 K) |
| Hustota | 3.98 g/dm3[1] |
| Rozpustnost ve vodě | 10,2 g/l |
| Struktura | |
| Krystalová struktura | tetragonální |
| Bezpečnost | |
| H-věty | H302, H312, H315, H319, H332, H335 |
| P-věty | P261, P264, P270, P271, P280, P301+312, P302+352, P304+312, P304+340, P305+351+338, P312, P321, P322, P330, P332+313, P337+313, P362, P363, P403+233, P405, P501 |
Některá data mohou pocházet z datové položky. | |
Fluorid manganatý je anorganická sloučenina s chemickým vzorcem MnF2. Je to světle růžová pevná látka.
Příprava
Fluorid manganatý lze připravit reakcí uhličitanu manganatého s kyselinou fluorovodíkovou.[2] Takto byl připraven v roce 1824 Jönsem Jacobem Berzeliem:[3]
MnCO3 + 2HF → MnF2 + CO2 + H2O
Fluorid manganatý může být také připraven přímo z prvků:[4]
Mn + F2 → MnF2
Tetrahydrát fluoridu manganatého vzniká pomalým odpařováním roztoku fluoridu manganatého.[3]
Vlastnosti
Fluorid manganatý je málo rozpustný ve vodě. Stejně jako některé fluoridy kovů v oxidačním stavu II, fluorid manganatý krystalizuje ve struktuře rutilu, čímž vznikají oktaedrická centra manganu a planární fluoridy.[5]
Využití
Fluorid manganatý se používá při výrobě speciálních druhů skel a laserů.[6] Je kanonickým příkladem jednoosého antiferomagnetu (s Néelovou teplotou 68 K).[7] Fluorid manganatý je také využíván jako katalyzátor při syntéze pyridinu.[8]
Reference
V tomto článku byly použity překlady textů z článků Manganese(II) fluoride na anglické Wikipedii a Mangan(II)-fluorid na německé Wikipedii.
- ↑ GRIFFEL, Maurice; STOUT, J. W. Preparation of Single Crystals of Manganous Fluoride. The Crystal Structure from X-Ray Diffraction. The Melting Point and Density. Journal of the American Chemical Society. 1950-10, roč. 72, čís. 10, s. 4351–4353. Dostupné online [cit. 2023-07-29]. ISSN 0002-7863. DOI 10.1021/ja01166a004. (anglicky)
- ↑ Handbuch der präparativen anorganischen Chemie. 1. 3., umgearb. Aufl. vyd. Stuttgart: Enke 608 s. ISBN 978-3-432-02328-1. S. 268.
- ↑ a b Gmelin Handbook of Inorganic Chemistry. [s.l.]: Springer-Verlag 316 s. Dostupné online. ISBN 978-0-387-93343-6. S. 5. (německy) Google-Books-ID: eWE6AQAAIAAJ.
- ↑ WebElements Periodic Table » Manganese » reactions of elements. www.webelements.com [online]. [cit. 2023-07-29]. Dostupné v archivu pořízeném z originálu dne 2020-06-25.
- ↑ STOUT, J. W.; REED, Stanley A. The Crystal Structure of MnF 2 , FeF 2 , CoF 2 , NiF 2 and ZnF 2. Journal of the American Chemical Society. 1954-11, roč. 76, čís. 21, s. 5279–5281. Dostupné online [cit. 2023-07-29]. ISSN 0002-7863. DOI 10.1021/ja01650a005. (anglicky)
- ↑ AYRES, D. C.; HELLIER, Desmond. Dictionary of environmentally important chemicals. London: Blackie academic & professional, 1998. Dostupné online. ISBN 978-0-7514-0256-8.
- ↑ FELCHER, G. P; KLEB, R. Antiferromagnetic domains and the spin-flop transition of MnF 2. Europhysics Letters (EPL). 1996-11-20, roč. 36, čís. 6, s. 455–460. Dostupné online [cit. 2023-07-29]. ISSN 0295-5075. DOI 10.1209/epl/i1996-00251-7.
- ↑ SHIMIZU, Shinkichi; WATANABE, Nanao; KATAOKA, Toshiaki. Pyridine and Pyridine Derivatives. Ullmann's Encyclopedia of Industrial Chemistry. 2000-06-15. Dostupné online [cit. 2023-07-29]. DOI 10.1002/14356007.a22_399.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Fluorid manganatý, MnF2


