Fluorid rtuťný
| Fluorid rtuťný | |
|---|---|
| Systematický název | Fluorid rtuťný |
| Anglický název | Mercury(I) fluoride |
| Německý název | Quecksilber(I)-fluorid |
| Sumární vzorec | Hg2F2 |
| Vzhled | žluté krychlové krystaly |
| Identifikace | |
| Registrační číslo CAS | 13967-25-4 |
| EC-no (EINECS/ELINCS/NLP) | 237-747-9 |
| PubChem | 4084556 |
| SMILES | F[Hg][Hg]F |
| InChI | InChI=1S/2FH.2Hg/h2*1H;;/q;;2*+1/p-2 |
| Vlastnosti | |
| Molární hmotnost | 439,177 g/mol |
| Teplota tání | 570 °C |
| Hustota | 8,37 g/cm3 (pevné skupenství) |
| Součin rozpustnosti | 3,1 . 10−6[1] |
| Bezpečnost | |
| H-věty | H300 H310 H330 H373 H410 |
| P-věty | P260 P301+310 P304+340 P320 P330 P361 P405 P501 |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Fluorid rtuťný je chemická sloučenina rtuti a fluoru se vzorcem Hg2F2.[2] Skládá se z malých žlutých krystalů krychlového tvaru, které na světle černají.[3]
Syntéza
Fluorid rtuťný se připravuje reakcí uhličitanu rtuťného s kyselinou fluorovodíkovou:
Hg2CO3 + 2 HF → Hg2F2 + CO2 + H2O
Reakce
Fluorid rtuťný po přidání do vody hydrolyzuje na elementární kapalnou rtuť, oxid rtuťnatý a kyselinu fluorovodíkovou:[3]
Hg2F2 + H2O → Hg + HgO + 2 HF
Lze jej použít ve Swartsově reakci k přeměně halogenalkanů na alkylfluoridy:[4]
2 R-X + Hg2F2 → 2 R-F + Hg2X2
Struktura
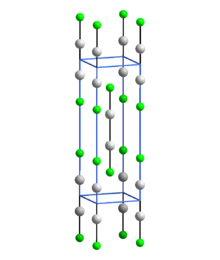
Stejně jako ostatní rtuťné sloučeniny, které obsahují lineární jednotky X-Hg-Hg-X, obsahuje Hg2F2 lineární jednotky FHg2F s délkou vazby Hg-Hg 251 pm (délka Hg-Hg v kovu je 300 pm) a délkou vazby Hg-F 214 pm.[5] Celková koordinace každého atomu rtuti je deformovaný osmistěn.[5] Sloučenina se často formuluje jako Hg 2+
2 2F−.[6]
Reference
V tomto článku byl použit překlad textu z článku Mercury(I) fluoride na anglické Wikipedii.
- ↑ RUMBLE, John. CRC Handbook of Chemistry and Physics. 99. vyd. [s.l.]: CRC Press, 2018. Dostupné online. ISBN 978-1138561632. S. 5–189. (anglicky)
- ↑ HRNČÍŘ, Jan. Sloučeniny [online]. Liberec: Gymnázium F. X. Šaldy [cit. 2022-06-05]. Dostupné online.
- ↑ a b PERRY, Dale L.; PHILLIPS, Sidney L. Handbook of Inorganic Compounds. [s.l.]: CRC Press, 1995. "Mercury(I)+fluoride"&pg=PA256&redir_esc=y#v=snippet&q="Mercury(I)%20fluoride"&f=false Dostupné online. ISBN 0-8493-8671-3. S. 256.
- ↑ BEYER, Hans; WALTER, Wolfgang; LLOYD, Douglas. Beyer/Walter Organic Chemistry. [s.l.]: Horwood Publishing "Mercury(I)+fluoride"&pg=PA136&redir_esc=y Dostupné online. ISBN 1-898563-37-3. S. 136.
- ↑ a b WELLS, Alexander Frankj. Structural Inorganic Chemistry. 5. vyd. Oxford: Clarendon Press, 1984. Dostupné online. ISBN 0-19-855370-6.
- ↑ COTTON, F. Albert; WILKINSON, Geoffrey; MURILLO, Carlos A., Manfred Bochmann. Advanced Inorganic Chemistr. 6. vyd. New York: Wiley-Interscience, 1999. Dostupné online. ISBN 0-471-19957-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid rtuťný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid rtuťný na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.








