Fluorid sírový
| Fluorid sírový | |
|---|---|
 Vzorec | |
 3D model | |
| Obecné | |
| Systematický název | Fluorid sírový, hexafluorid síry |
| Ostatní názvy | hexafluor-λ6-sulfan |
| Anglický název | sulfur hexafluoride |
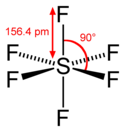
| Sumární vzorec | SF6 |
| Vzhled | Bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 2551-62-4 |
| Číslo RTECS | VZ4725000 |
| Vlastnosti | |
| Molární hmotnost | 146,06 g/mol |
| Teplota tání | sublimace: −64 °C; 209 K |
| Teplota varu | −50,8 °C; 222,3 K |
| Hustota | 6,63 kg/m3 |
| Struktura | |
| Krystalová struktura | Kosočtverečná |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | Žádné |
| S-věty | S38 |
| NFPA 704 | |
| Teplota vznícení | Není vznětlivý |
Některá data mohou pocházet z datové položky. | |
Fluorid sírový (též hexafluorid síry, někdy označovaný podle vzorce SF6) je bezbarvá, plynná, anorganická chemická látka se vzorcem SF6. Tato látka je nepolární a má vysokou hustotu, asi 6krát vyšší, než je hustota vzduchu. Na rozdíl od ostatních fluoridů síry není jedovatý, proto se používá při různých fyzikálních pokusech a je v elektrotechnickém průmyslu používán jako izolační plyn. Podle IPCC je SF6 skleníkovým plynem a za posledních 16 let se jeho koncentrace v ovzduší téměř zdvojnásobila (viz graf). Evropská komise navrhla v roce 2023 zakázat jeho používání.[2]

Výroba
Roku 1901 Henri Moissan a Paul Lebeau objevili, že fluorid sírový vzniká, společně s fluoridem siřičitým (SF4) a dekafluoridem disíry (S2F10), reakcí síry a fluoru (avšak je kontaminován ostatními fluoridy a fluorem, dále probíhá čištění).
- S8 + 24F2 → 8SF6
Dále je potřeba odstranit ostatní produkty, které jsou jedovaté. Zahříváním se rozpadne dekafluorid disíry, a fluorid siřičitý se odstraňuje reakcí s hydroxidem sodným (NaOH), kde vznikají fluorid sodný (NaF) a síran sodný (Na2SO4).
- S2F10 → SF4 + SF6
- SF4 + 6NaOH → Na2SO3 + 4NaF + 3H2O
- 2F2 + 4NaOH → 4NaF + 2H2O + O2
- SF4 + 6NaOH → Na2SO3 + 4NaF + 3H2O
Fluorid sírový je inertní, nereaguje dokonce ani s roztaveným sodíkem, ale je schopen exotermně reagovat s lithiem.
Použití
Ročně se vyrobí asi 8 000 tun této látky. Asi 70 % se využije v elektrotechnickém průmyslu jako dielektrikum (elektrický izolant), dále se využívá při odlévání reaktivních kovů, např. hořčíku, a na plynnou výplň oken. V medicíně se využívá jako negativní kontrastní látka při ultrasonografii ve formě mikrobublinek obalených fosfolipidovou membránou.[3]
Zákaz používání
Kvůli vysokému vlivu plynu SF6 na skleníkový efekt bude jeho použití zakázáno.[2] Proto jsou hledány náhrady za SF6, které jsou ale dražší, nedosahují tak dobrých izolačních schopností a vyžadují změny konstrukce dotčených elektrických zařízení.[4]
Změna hlasu
Fluorid sírový je schopen při vdechnutí měnit hlas. Helium má nízkou molární hmotnost, asi 4 g/mol, což je nižší než vzduch, který má hmotnost (výpočtem) asi 30 g/mol, tedy i nižší hustotu. Hélium tedy zvyšuje frekvenci hlasu. Naopak fluorid sírový, který má molární hmotnost asi 146 g/mol, několikanásobně snižuje frekvenci hlasu, tedy vytváří hlubší hlas. Hluboký hlas zůstane po mnohem delší dobu než vysoký hlas u hélia, jelikož tento těžký plyn se z plic špatně dostává pryč, na rozdíl od helia, které je lehčí než vzduch. Rychlost zvuku ve fluoridu sírovém je asi 2,3krát nižší než ve vzduchu.[5][6]
Reference
- ↑ a b Sulfur hexafluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ a b Svaz: Zákaz izolačního plynu s fluoridem ohrozí spolehlivost elektrické sítě. Ekolist.cz [online]. 2023-03-03 [cit. 2023-03-03]. Dostupné online.
- ↑ CABASSA, Paolo; BIPAT, Shandra; LONGARETTI, Laura. Liver Metastases: Sulphur Hexafluoride–Enhanced Ultrasonography for Lesion Detection: A Systematic Review. Ultrasound in Medicine & Biology. 2010-10, roč. 36, čís. 10, s. 1561–1567. Dostupné online [cit. 2024-11-20]. DOI 10.1016/j.ultrasmedbio.2010.06.004. (anglicky)
- ↑ BLÜMELOVÁ, Kristina. Vysokonapěťové rozvaděče mají zásluhou českých vědců náhradu za izolační plyn SF6. Technický týdeník. 2021-07-25. Dostupné online [cit. 2023-03-03].
- ↑ SPANGLERSCIENCETV. Sulfur Hexafluoride - Deep Voice Gas. [s.l.]: [s.n.] Dostupné online.
- ↑ Changing Voice. The Wonders of Physics [online]. [cit. 2024-08-27]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid sírový na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid sírový na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Graph shows the concentration of sulfur hexafluoride (SF6) in earth's atmosphere versus time. X-axis data interval is weekly, starting May 1997. Y-axis concentration is picamole per mole (parts per trillion).
Atmospheric samples were gathered within evacuated flasks from the Mauna Loa Observatory Hawaii, then sealed and transported to Boulder Colorado for analysis. Similar observations gathered from other remote sampling sites around the world validate that these data represent a well-mixed gas throughout the atmosphere.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gases under pressure
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.