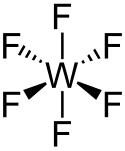
Fluorid wolframový
| Fluorid wolframový | |
|---|---|
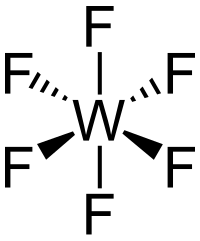 Strukturní vzorec | |
 Kuličkový model | |
| Obecné | |
| Systematický název | Fluorid wolframový |
| Anglický název | Tungsten hexafluoride (Hexafluorotungsten) |
| Německý název | Wolfram(VI)-fluorid |
| Sumární vzorec | WF6 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 7783-82-6 |
| PubChem | 522684 |
| Vlastnosti | |
| Molární hmotnost | 297,830 g.mol−1 |
| Teplota tání | 2,3 °C (275,4 K) |
| Teplota varu | 17,1 °C (290,2 K) |
| Teplota změny krystalové modifikace | −9 °C |
| Hustota | 12,4 g.dm−3 (plyn) 3,44 g/cm3 (15 °C, kapalný) 4,56 g/cm3 (−9 °C, pevný) |
| Rozpustnost ve vodě | hydrolyzuje |
| Měrný elektrický odpor | 5,6 μΩ·cm |
| Bezpečnost | |
| H-věty | H280, H301+H311, H314, H330 |
| P-věty | P260, P264, P264+265, P270, P271, P280, P284, P301+316, P301+330+331, P302+352, P302+361+354, P304+340, P305+354+338, P316, P317, P320, P321, P330, P361+364, P363, P403+233, P405, P410+403, P501 |
Některá data mohou pocházet z datové položky. | |
Fluorid wolframový, někdy též hexafluorid wolframu, je anorganická sloučenina s chemickým vzorcem WF6 (v angličtině i F6W[1]). Je to toxický, žíravý, bezbarvý plyn s hustotou asi 13 kg/m3 (zhruba 11krát těžší než vzduch).[2][3][4] Je to jeden z nejhustších známých plynů za standardních podmínek.[5][6] WF6 se běžně používá v polovodičovém průmyslu k nanášení wolframových filmů s využitím chemické depozice z plynné fáze. Tato vrstva vytváří vodivé spoje s nízkým odporem.[2] Je to jeden ze sedmnácti známých binárních hexafluoridů.
Vlastnosti
Molekula WF6 je oktaedrická s grupou symetrií Oh . Délky W–F vazeb jsou 183,2 pm. V rozmezí teplot 2,3 °C až 17 °C je fluorid wolframový bezbarvá kapalina o hustotě 3440 kg/m3 při 15°C.[7][4] Při 2,3 °C tuhne na bílou pevnou látku s krychlovou krystalickou strukturou, mřížkovou konstantou 628 pm a vypočtenou hustotou 3990 kg/m3. Při −9 °C se struktura přemění na kosočtverečnou s mřížkovými konstantami a = 960,3 pm, b = 871,3 pm a c = 504,4 pm a hustotou 4560 kg/m3. V této fázi je vzdálenost W–F 181 pm. Zatímco plynný WF6 je jedním z nejhustších plynů, jehož hustota převyšuje hustotu nejtěžšího elementárního plynu radonu (9,73 g/l), hustota v kapalném a pevném stavu je spíše průměrná.
Tlak par v rozmezí teplot −70 °C a 17 °C lze popsat rovnicí
- log10 P = 4,55569 − 1021,208 ⁄ T + 208.45,
kde P = tlak par (bar), T = teplota (°C).[8][9]
Příprava a výroba
Fluorid wolframový se obvykle vyrábí exotermickou reakcí plynného fluoru s wolframovým práškem při teplotě mezi 350 °C a 400 °C:[7]
- W + 3 F2 → WF6
Plynný produkt se destilací oddělí od WOF4 (obvyklá nečistota). Ve variantě přímé fluorace se kov umístí do vyhřívaného reaktoru, mírně natlakovaného na 8 až 14 kPa a protékaného konstantním proudem WF6 s malým podílem plynného fluoru.
Plynný fluor ve výše uvedené metodě může být nahrazen ClF, ClF3 nebo BrF3. Alternativním postupem výroby fluoridu wolframového je reakce oxidu wolframového (WO3) s HF, BrF3, popř. SF4. Fluorid wolframový lze také získat konverzí chloridu wolframového pomocí HF, AsF3 nebo SbF5 [5]
- WCl6 + 6 HF → WF6 + 6 HCl nebo
- WCl6 + 2 AsF3 → WF6 + 2 AsCl3 nebo
- WCl6 + 3 SbF5 → WF6 + 3 SbF3Cl2
- WCl6 + 2 AsF3 → WF6 + 2 AsCl3 nebo
Reakce
Ve styku s vodou nebo vodní parou vzniká fluorovodík (HF) a fluoridy-oxidy wolframu, případně až oxid wolframový:[5]
- WF6 + H2O → WOF4 + 2 HF
- WF6 + 2 H2O → WO2F2 + 4 HF
- WF6 + 3 H2O → WO3 + 6 HF
- WF6 + 2 H2O → WO2F2 + 4 HF
Na rozdíl od některých jiných fluoridů kovů, WF6 není dobrým fluoračním činidlem ani silným oxidantem. WF6 lze zredukovat na fluorid wolframičitý (WF4).[10]
Aplikace v polovodičovém průmyslu
Nejrozšířenější použití fluoridu wolframového je v polovodičovém průmyslu, kde se používá pro nanášení kovového wolframu pomocí chemické depozice z plynné fáze . V souvislosti s rozvojem polovodičového průmyslu v 80. a 90. letech 20. století vzrostla spotřeba fluoridu wolframového na úroveň kolem 200 tun ročně.[5] V roce 2020 dosáhla spotřeba 4620 tun ročně s trvale rostoucí tendencí.[11]
Kovový wolfram je ve výrobě polovodičů atraktivní díky své relativně vysoké tepelné a chemické stabilitě, nízkému měrnému odporu (5,6 μΩ·cm) a velmi nízké elektromigraci. Výhodou WF6 oproti příbuzným sloučeninám jako WCl6 nebo WBr6 je vyšší tlak par a tedy vyšší rychlosti depozice. Byly vyvinuty dva způsoby depozice: tepelný rozklad a redukce vodíkem. Požadovaná čistota plynu je poměrně vysoká, v závislosti na aplikaci se pohybuje mezi 99,98 % a 99,9995 %.[5]
Jiné aplikace
Mimo polovodičový průmysl je fluorid wolframový používán k výrobě karbidu wolframu metodou chemické depozice z plynné fáze.[12]
Jako těžký plyn lze fluorid wolframový použít jako pufr pro řízení reakcí plynů. Například zpomaluje rychlost chemické reakce Ar/H2/O2 plamene, což vede ke snížení teploty plamene. [13]
Bezpečnost
Fluorid wolframový je extrémně žíravý, protože reaguje s vlhkostí v organických materiálech za vzniku kyseliny fluorovodíkové. Zásobní nádoby musí mít teflonová těsnění.[14]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Tungsten hexafluoride na anglické Wikipedii.
- ↑ Tungsten hexafluoride. PubChem [online]. National Library of Medicine [cit. 2023-12-02]. Dostupné online. (anglicky)
- ↑ a b ROUCAN, Jean-Pierre. Proprietes Physiques des Composes Mineraux. [s.l.]: Ed. Techniques Ingénieur (Techniques Ingénieur). Dostupné online. S. 138. (francouzsky)
- ↑ Tabulka vlastností plynů (Wayback Machine archive 7 September 2022)
- ↑ a b TRENTO, Chin. MSDS of Tungsten Hexafluoride. www.samaterials.com [online]. Stanford Advanced Materials [cit. 2023-12-01]. Dostupné online. (anglicky)
- ↑ a b c d e LASSNER, Erik; SCHUBERT, Wolf-Dieter. Tungsten: Properties, Chemistry, Technology of the Elements, Alloys, and Chemical Compounds. [s.l.]: Springer Science & Business Media, 1999. 422 s. Dostupné online. ISBN 0306450534. doi:10.1007/978-1-4615-4907-9. (anglicky)
- ↑ THE HEAVIEST GAS IN THE WORLD. Tungsten Hexafluoride. WF6. YouTube [online]. 30. 11. 2023 [cit. 2023-12-01]. Dostupné online. (anglicky)
- ↑ a b PRIEST, Homer F.; SWINEHERT, Carl F. Inorganic Syntheses [online]. Wiley, 1950 [cit. 2023-12-01]. Kapitola Anhydrous Metal Fluorides, s. 171–183. Dostupné online. doi:10.1002/9780470132340.ch47.
- ↑ CADY, George H.; HARGREAVES, George B. Vapour Pressures of Some Fluorides And Oxyfluorides of Molybdenum, Tungsten, Rhenium, and Osmium. S. 1568–1574. Journal of Chemical Society [online]. The Royal Society of Chemistry [cit. 2023-12-01]. Roč. 1961, s. 1568–1574. Dostupné online. doi:10.1039/JR9610001568. (anglicky)
- ↑ Tungsten hexafluoride. NIST WebBook Chemie, SRD 69 [online]. NIST [cit. 2023-12-01]. Dostupné online. (anglicky)
- ↑ GREENWOOD, N. N.; EARNSHAW, A. Chemistry of the Elements. 2.. vyd. Oxford: Butterworth-Heinemann ISBN 0-7506-3365-4. (anglicky)
- ↑ Global Tungsten Hexafluoride Market Analysis. pmarketresearch.com [online]. PW Consulting Agency [cit. 2023-12-01]. Dostupné online. (anglicky)
- ↑ PIERSON, Hugh O. Chemical Vapor Deposition (CVD): Principles, Technology, and Applications. 1.. vyd. [s.l.]: Elsevier, 1999. Dostupné online. ISBN 9780815513001, ISBN 9781437744880. (anglicky)
- ↑ IFEACHO, Pascal. Semi-conducting metal oxide nanoparticles from a low-pressure premixed H2/O2/Ar flame: Synthesis and Characterization. [s.l.]: Cuvillier Verlag, 2008. Dostupné online. ISBN 978-3-86727-816-4.
- ↑ Tungsten hexafluoride MSDS [online]. Linde Gas. Dostupné v archivu pořízeném z originálu dne 2010-02-12.
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid wolframový na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid wolframový na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gases under pressure
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Structure of tungsten hexafluoride
Tungsten hexafluoride, 3D balls