Fosforečnany

HPO42−; barevné značení: P (fialová); O (červená); H (bílá)
Fosforečnany nebo také fosfáty (PO 3-
4 ) jsou soli kyseliny trihydrogenfosforečné (H3PO4), které vzniknou odtržením všech tří atomů vodíku. Fosfáty jsou důležitá skupina látek v biochemii.
Chemické vlastnosti
Fosfátový anion má tetraedrickou strukturu (grupa symetrie Td), okolo atomu fosforu jsou čtyři identické atomy kyslíku. Náboj iontu je -3, jeho konjugovanou kyselinou je HPO 2-
4 (hydrogenfosforečnan), který je dále konjugovanou bází H2PO -
4 (dihydrogenfosforečnanu). Dihydrogenfosforečnan je konjugovanou bází kyseliny fosforečné.
Výskyt
Fosfáty se v přírodě vyskytují v mnoha minerálech, např. monazit, apatit aj.
V biologických systémech se fosfát nachází v anorganické iontové formě (značí se Pi) a vzniká hydrolýzou difosfátu PPi:
- P2O 2-
7 + H2O → 2 HPO 2-
4
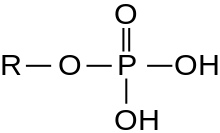
Mnohem častěji ale v živých systémech nacházíme fosfáty v organické formě. V tomto případě jde v podstatě o estery kyseliny fosforečné (R-O-P(O)(OH)2); difosfáty[pozn. 1] – estery kyseliny difosforečné (R-O-P(O)(OH)-O-P(O)(OH)2) a trifosfáty[pozn. 1] – estery kyseliny trifosforečné (R-O-P(O)(OH)-O-P(O)(OH)-O-P(O)(OH)2). Příkladem jsou adenozinfosfáty (AMP, ADP, ATP) a v nukleových kyselinách DNA a RNA. Adenozinfosfáty jsou pro organismy velmi důležité, protože díky makroenergetické vazbě mezi fosfátovými jednotkami slouží jako zásobárna energie.
Použití
Hlavní použití je výroba hnojiv. Fosforečnany se též často používají k snížení tvrdosti vody vázáním iontů vápníku a hořčíku.
Odkazy
Poznámky
- ↑ a b Jsou-li však v molekule dvě (mono)fosfátové skupiny, látku označujeme jako bisfosfát, jsou-li tři (mono)fosfátové skupiny, tak trisfosfát (např. inositoltrisfosfát), atd.
Reference
Externí odkazy
 Obrázky, zvuky či videa k tématu fosforečnany na Wikimedia Commons
Obrázky, zvuky či videa k tématu fosforečnany na Wikimedia Commons
Média použitá na této stránce
atomic structure of inorganic phosphate (HPO4[2-]), rendered with PyMol (www.pymol.org), color coding for atoms: P, purple; O, red; H, white.
Autor: Trengarasu, Licence: CC BY-SA 3.0
Phosphate functional group chemical structure.

