Fosfonium
Fosfonium je označení víceatomových kationtů s obecným vzorcem PR +
4 (R jsou alkylové nebo arylové skupiny či halogeny). Jejich molekuly mají tetraedrický tvar a většinou jsou bezbarvé.[1]
Druhy fosfoniových kationtů
Fosfoniový kation
„Základním“ fosfoniovým iontem je PH +
4 . K jeho solím patří například jodid fosfonia (PH +
4 I−). Soli tohoto iontu se využívají zřídka; jsou mimo jiné meziprodukty při přípravě tetrakis(hydroxymethyl)fosfoniumchloridu, který se používá v chemickém průmyslu:
- PH3 + HCl + 4 CH2O → P(CH2OH) +
4 Cl−
Protonované organofosfiny
Řada fosfoniových solí se připravuje protonací primárních, sekundárních i terciárních fosfinů:
- PR3 + H+ → HPR +
3
Fosfiny s alkylovými skupinami bývají silnějšími zásadami než fosfiny, na které jsou navázány arylové skupiny.[2]
Organické fosfoniové ionty
Nejběžnějším druhem fosfoniových iontů jsou ty, které mají na atom fosforu navázané organické funkční skupiny. Ke kvaternárním fosfoniovým kationtům patří mimo jiné tetrafenylfosfonium (C6H5)4P+ a tetramethylfosfonium (CH3)4P+.

[3]

Kvaternární fosfoniové kationty (PR +
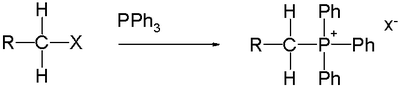
4 ) se připravují alkylací organických derivátů fosfanu; například reakcí trifenylfosfinu s jodmethanem vzniká methyltrifenylfosfoniumjodid, používaný jako prekurzor Wittigových reaktantů.[5]
- P(C6H5)3 + CH3I → [CH3P(C6H5)3]+I−
Chlorid fosforečný a odvozené halogenfosfoniové sloučeniny
Pevný chlorid fosforečný je iontová sloučenina se vzorcem PCl +
4 PCl -
6 a tedy v podstatě sůl tetrachlorfosfoniového kationtu.[6][7] Ve zředěných roztocích disociuje podle této rovnice:
- PCl5 ⇌ PCl +
4 + Cl−
Trifenylfosfindichlorid ((C6H5)3PCl2) se může, v závislosti na použitém rozpouštědlu, vyskytovat jak ve fosforanové formě, tak i jako chlortrifenylfosfoniumchlorid.[8] Jeho vlastnosti jsou podobné jako u PCl5. V polárních rozpouštědlech je přítomen jako iontová sloučenina (P(C6H5)3Cl)+Cl− v nepolárních rozpouštědlech jako kovalentní molekula s trigonální bipyramidovou geometrií.[9]
Použití

Tetrakis(hydroxymethyl)fosfoniumchlorid (THPC) se využívá v textilním průmyslu při výrobě tkanin odolných vůči pomačkání a schopných zpomalovat hoření.[10][11] THPC reaguje s močovinou, která kondenzuje s jeho hydroxylovými skupinami, přičemž se vytváří struktura podobná fosfinoxidu.[12][13]
Katalyzátory a srážecí činidla
Organické fosfoniové kationty jsou lipofilní a mohou být použity jako katalyzátory fázového přenosu podobně jako kvartérní amoniové soli.
Tetrafenylfosfoniový kation (P(C6H5) +
4 ) lze použít jako účinné srážecí činidlo.
Reaktanty v organické syntéze
V organické syntéze se používají Wittigovy reaktanty, které se připravují z fosfoniových solí získávaných deprotonací alkylfosfoniových solí pomocí silných zásad, jako jsou například butyllithium a amid sodný:
- [(C6H5)3P+CH2R]X− + C4H9Li → (C6H5)3P=CHR + LiX + C4H10
Jedním z nejjednodušších ylidů je methylentrifenylfosforan ((C6H5)3P=CH2).[5]
V Kirsanovově reakci se jako reaktanty používají sloučeniny s obecným vzorcem (C6H5)PX2 (kde X je Cl nebo Br).[14]
Při Kinnearově–Perrenově reakci se připravují alkylfosfonyldichloridy (RP(O)Cl2) a alkylfosfonátové estery (RP(O)(OR')2). Alkylací chloridu fosforitého za přítomnosti chloridu hlinitého se tvoří alkyltrichlorfosfoniové soli, využívané při této reakci jako meziprodukty.
- RCl + PCl3 + AlCl3 → [RPCl3]+AlCl4−
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Fosfonium na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fosfonium na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Phosphonium na anglické Wikipedii.
- ↑ D. E. C. Corbridge. Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology. Amsterdam: Elsevier, 1995. (5). ISBN 978-0-444-89307-9.
- ↑ T. Li; A. J. Lough; R. H. Morris. An Acidity Scale of Tetrafluoroborate Salts of Phosphonium and Iron Hydride Compounds in [D2]Dichloromethane. Chemistry: A European Journal. 2007, s. 3796–3803. PMID 17245785.
- ↑ H. F. Klein. Trimethylphosphonium Methylide (Trimethyl Methylenephosphorane). Inorganic Syntheses. 1978, s. 138–140. ISBN 9780470132494.
- ↑ A. Finch; A. N. Fitch; P. N. Gates. Crystal and Molecular structure of a metastable modification of phosphorus pentachloride. Journal of the Chemical Society, Chemical Communications. 1993, s. 957–958. ISBN 9780470132494.
- ↑ a b GEORG WITTIG, U. SCHOELLKOPF. Methylenecyclohexane (describes Ph3PCH2). Org. Synth.. 1973. Dostupné online.; Coll. Vol.. S. 751.
- ↑ A. F.Holleman; E. Wiber; N. Wiberg. Inorganic Chemistry. [s.l.]: Academic Press, 2001. ISBN 978-0-12-352651-9.
- ↑ R. W. Suter; H. C. Knachel; V. P. Petro; J. H. Howatson; S. G. Shore. Nature of Phosphorus(V) Chloride in Ionizing and Nonionizing Solvents. Journal of the American Chemical Society. 1978, s. 1474–1479.
- ↑ S. M. Godfrey; C. A. McAuliffe; R. G. Pritchard; J. M. Sheffield. An X-ray crystallorgraphic study of the reagent Ph3PCl2; not charge-transfer, R3P–Cl–Cl, trigonal bipyramidal or [R3PCl]Cl but an unusual dinuclear ionic species, [Ph3PCl+⋯Cl–⋯+CIPPh3]Cl containing long Cl–Cl contacts. Chemical Communications. 1996, s. 2521–2522.
- ↑ E. V. Jennings; K. Nikitin; Y. Pritchard; D. G. Gilheany. Degenerate Nucleophilic Substitution in Phosphonium Salts. Journal of the American Chemical Society. 2014, s. 16217–16226. PMID 25384344.
- ↑ Edward D. Weil; Sergei V. Levchik. Flame Retardants in Commercial Use or Development for Textiles. Journal of Fire Sciences. 2008, s. 243–281.
- ↑ Svara, Jürgen; Weferling, Norbert ; Hofmann, Thomas. Phosphorus Compounds, Organic. Ullmann's Encyclopedia of Industrial Chemistry. John Wiley & Sons, Inc, 2008 DOI:10.1002/14356007.a19_545.pub2
- ↑ Frequently asked questions: What is the PROBAN® process? [online]. Rhodia Proban [cit. 2013-02-25]. Dostupné v archivu pořízeném dne 2012-12-07.
- ↑ Wilson A. Reeves; John D. Guthrie. Intermediate for Flame-Resistant Polymers-Reactions of Tetrakis(hydroxymethyl)phosphonium Chloride. Industrial and Engineering Chemistry. 1956, s. 64–67.
- ↑ Studies in Organophosphorus Chemistry. I. Conversion of Alcohols and Phenols to Halides by Tertiary Phosphine Dihalides G. A. Wiley, R. L. Hershkowitz, B. M. Rein, B. C. Chung Journal of the American Chemical Society, 1964, 86 (5), pp 964–965 DOI:10.1021/ja01059a073
Média použitá na této stránce
Autor: Smokefoot, Licence: CC BY-SA 4.0
structure of phosphorus pentachloride, illustrating its autoionization.