Friedelova–Craftsova reakce
Friedelova–Craftsova reakce (též Friedel–Craftsova reakce) je souhrnné označení organických reakcí, které objevili roku 1877 Charles Friedel a James Crafts. Tyto reakce slouží k zavedení substituentů na aromatická jádra.[1] Dělí se na dva základní typy: alkylační a acylační reakce. V obou případech se jedná o elektrofilní aromatickou substituci.[2][3][4][5]
Friedelova–Craftsova alkylace
Friedelova–Craftsova alkylace spočívá v alkylaci aromatického jádra alkylhalogenidem za přítomnosti silné Lewisovy kyseliny jako katalyzátoru.[6] Při použití bezvodého chloridu železitého se alkylová skupina připojí na místo, kde se předtím vytvořil chloridový ion. Obecný mechanismus je uveden na následujícím obrázku:
Nevýhodou této reakce je větší nukleofilita produktu oproti reaktantu, což často vede k vícenásobné alkylaci. V praxi je využitelná pouze pro alkylace terciárními a některými sekundárními alkylačními činidly či činidly, která vytvářejí stabilizované karbokationty. U primárních alkylhalogenidů dochází u vzniklého karbokationtu k přesmykové reakci.
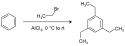
Počet možných alkylací může být omezen sterickými efekty; k tomu dochází například při t-butylaci 1,4-dimethoxybenzenu.
- (c) V8rik, CC BY-SA 3.0
Friedelovy–Craftsovy reakce mohou proběhnout, ať už vznikne jakýkoliv karbokationtový meziprodukt, lze připojovat alkany, alkeny, enony i epoxidy. Příkladem může být příprava neofylchloridu z benzenu a methylallylchloridu:[7]
- H2C=C(CH3)CH2Cl + C6H6 → C6H5C(CH3)2CH2Cl
Při jedné studii byl jako elektrofil použit bromoniový ion odvozený od alkenu a N-bromsukcinimidu (NBS)[8]
- (c) V8rik at the English Wikipedia project, CC BY-SA 2.5
Při této reakci byl k aktivaci NBS sloužícího jako donor halogenů použit triflát samaritý.
Friedelova–Craftsova dealkylace
Friedelova–Craftsova dealkylace je vratná. Při obrácené Friedelově–Craftsově alkylaci či Friedelově–Craftsově dealkylaci se alkylové skupiny odstraňují za přítomnosti protonu nebo Lewisovy kyseliny.
Příkladem je vícenásobná substituce benzenu bromethanem. Při ní se dá očekávat, že se další substituenty naváží na pozice orto a para, jelikož jsou alkyly substituenty první třídy. Skutečným produktem trojnásobné substituce je však 1,3,5-triethylbenzen, který má substituenty v polohách meta,[9] substituce do polohy meta je zde termodynamicky výhodnější, jelikož dochází k menšímu sterickému napětí, a při dosažení rovnováhy tak v soustavě převažuje právě tento produkt, který je výsledkem řady alkylací a dealkylací.
Friedelova–Craftsova acylace
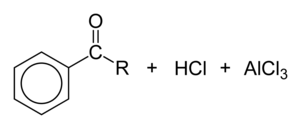
Při Friedelově–Craftsově acylaci se na aromatické jádro připojuje acyl. Jako acylační činidlo se nejčastěji používá příslušný acylchlorid a jako Lewisova kyselina chlorid hlinitý. Acylačním činidlem může být i anhydrid karboxylové kyseliny.[10] Podmínky reakce jsou velmi podobné jako u Friedelovy–Craftsovy alkylace. Díky snížení elektronové hustoty karbonylovou skupinou je vzniklý ketonový produkt vždy méně reaktivní než původní molekula, takže nedochází k vícenásobným substitucím; rovněž zde neprobíhají ani karbokationtové přesmyky, jelikož je acyliový ion stabilizován rezonanční strukturou s kladným nábojem na atomu kyslíku.
Využitelnost Friedelovy–Craftsovy acylace záleží na stabilitě použitého acylchloridu, formylchlorid je například příliš nestabilní na to, aby mohl být izolován. Syntéza benzaldehydu Friedelovým–Craftsovým postupem tak vyžaduje, aby byl formylchlorid připravován přímo na místě. Toho se dosahuje pomocí Gattermannovy reakce, kdy benzen reaguje s oxidem uhelnatým a chlorovodíkem za vysokého tlaku, přičemž jako katalyzátor slouží směs chloridu hlinitého a chloridu měďného.
Mechanismus reakce
Tato reakce začíná tvorbou acyliového centra a iontu AlCl −
4 :
Následně proběhne deprotonace areniového iontu a takto uvolněný proton reaguje s AlCl −
4 , čímž se obnoví původní AlCl3.
Vzniklý keton může být následně redukován na odpovídající alkan a výsledný produkt je pak stejný jako u Friedelovy–Craftsovy alkylace. Při tomto postupu ovšem nemůže dojít k přesmyku.[11]
Friedelova–Craftsova hydroxyalkylace
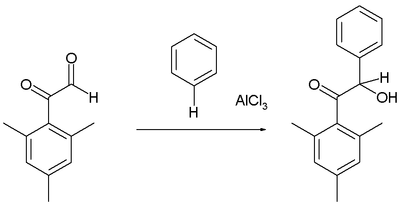
Areny mohou reagovat s některými aldehydy a ketony za vzniku hydroxyalkylovaných produktů, příkladem může být reakce mesitylderivátu glyoxalu s benzenem.[12]
Aldehydy jsou většinou reaktivnějšími elektrofily než fenony.
Použití
Výroba barviv
Friedelovy–Craftsovy reakce se využívají při výrobě některých triarylmethanových a xanthenových barviv.[13] Příkladem může být syntéza acidobazického indikátoru thymolftaleinu z thymolu a ftalanhydridu:
Reakcí ftalanhydridu s resorcinolem vzniká fluorescein. Pokud je místo resorcinolu použit N,N-diethylaminofenol, tak se vytvoří rodamin B:
Haworthova reakce
Haworthova reakce je reakce sloužící k výrobě 1-tetralonu.[14] Dochází při ní k reakci benzenu s anhydridem kyseliny jantarové, vytvořený meziprodukt je redukován a následně dochází po přidání kyseliny k druhé Friedelově–Craftsově acylaci.[15]
V podobném procesu se vytváří fenanthren z naftalenu a anhydridu kyseliny jantarové sérií reakcí, která začíná Friedelovou–Craftsovou acylací.
Friedelův–Craftsův test na aromatické sloučeniny
Reakcí chloroformu s aromatickými sloučeninami za přítomnosti chloridu hlinitého jako katalyzátoru vznikají triarylmethany, které často mají výrazné zabarvení (mnohé tyto sloučeniny se používají jako barviva). Tímto způsobem lze zjistit přítomnost aromatických sloučenin ve vzorku.[16]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Friedel–Crafts reaction na anglické Wikipedii.
- ↑ Friedel, C.; Crafts, J. M. (1877) "Sur une nouvelle méthode générale de synthèse d’hydrocarbures, d’acétones, etc.," Compt. Rend., 84: 1392 & 1450.
- ↑ Price, C. C. The Alkylation of Aromatic Compounds by the Friedel-Crafts Method. Organic Reactions. 1946, s. 1. ISBN 0471264180. DOI 10.1002/0471264180.or003.01.
- ↑ Groves, J. K. The Friedel–Crafts acylation of alkenes. Chemical Society Reviews. 1972, s. 73. DOI 10.1039/cs9720100073.
- ↑ Eyley, S. C. The Aliphatic Friedel–Crafts Reaction. Compr. Org. Synth.. 1991, s. 707–731. ISBN 978-0-08-052349-1. DOI 10.1016/B978-0-08-052349-1.00045-7.
- ↑ Heaney, H. The Bimolecular Aromatic Friedel–Crafts Reaction. Compr. Org. Synth.. 1991, s. 733–752. ISBN 978-0-08-052349-1. DOI 10.1016/B978-0-08-052349-1.00046-9.
- ↑ Rueping, M.; NACHTSHEIM, B. J. A review of new developments in the Friedel–Crafts alkylation – From green chemistry to asymmetric catalysis. Beilstein Journal of Organic Chemistry. 2010. DOI 10.3762/bjoc.6.6.
- ↑ SMITH, W. T. JR. AND SELLAS, J. T. Neophyl chloride. Org. Synth.. 1963. Dostupné online.
- ↑ Hajra, S.; MAJI, B.; BAR, S. Samarium Triflate-Catalyzed Halogen-Promoted Friedel–Crafts Alkylation with Alkenes. Organic Letters. 2007, s. 2783–2786. DOI 10.1021/ol070813t.
- ↑ ANSLYN, E.; WALLACE, K. J.; HANES, R.; MOREY, J.; KILWAY, K. V.; SIEGEL, J. Preparation of 1,3,5-Tris(aminomethyl)-2,4,6-triethylbenzene from Two Versatile 1,3,5-Tri(halosubstituted) 2,4,6-Triethylbenzene Derivatives. Synthesis. 2005, s. 2080–2083. DOI 10.1055/s-2005-869963.
- ↑ SOMERVILLE, L. F.; ALLEN, C. F. H. β-Benzoylpropionic acid. Organic Syntheses. 1933, s. 12. DOI 10.15227/orgsyn.013.0012.
- ↑ Friedel-Crafts Acylation. Organic-chemistry.org. Retrieved on 2014-01-11.
- ↑ Fuson, R. C.; WEINSTOCK, H. H.; ULLYOT, G. E. A New Synthesis of Benzoins. 2′,4′,6′-Trimethylbenzoin. Journal of the American Chemical Society. 1935, s. 1803–1804. DOI 10.1021/ja01313a015.
- ↑ MCCULLAGH, James V.; DAGGETT, Kelly A. Synthesis of Triarylmethane and Xanthene Dyes Using Electrophilic Aromatic Substitution Reactions. Journal of Chemical Education. 2007, s. 1799. DOI 10.1021/ed084p1799.
- ↑ Haworth, Robert Downs. Syntheses of alkylphenanthrenes. Part I. 1-, 2-, 3-, and 4-Methylphenanthrenes. Journal of the Chemical Society. 1932, s. 1125. DOI 10.1039/JR9320001125.
- ↑ Li, Jie Jack (2003) Name Reactions: A Collection of Detailed Reaction Mechanisms, Springer, ISBN 3-540-40203-9, p. 175.
- ↑ John C. Gilbert., Stephen F. Martin. Experimental Organic Chemistry: A Miniscale and Microscale Approach[nedostupný zdroj][nedostupný zdroj]. Brooks/Cole CENGAGE Learning, 2011. pp 872. 25.10 Aromatic Hydrocarbons and Aryl Halides - Classification test. ISBN 978-1-4390-4914-3
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Friedelova–Craftsova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Friedelova–Craftsova reakce na Wikimedia Commons
Média použitá na této stránce
Substitution of RCOCl or (RCO)2O onto benzene, a Friedel–Crafts acylation.
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Friedel Crafts hydroxyalkylation
(c) V8rik, CC BY-SA 3.0
Example of steric protection in Friedel-Crafts alkylation
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Thymolphthalein Synthesis
Mechanism for Friedel-Crafts alkylation
(c) V8rik at the English Wikipedia project, CC BY-SA 2.5
F-C alkylation with an alkene during a bromonium ion intermediate
Autor: Dissolution, Licence: CC BY-SA 3.0
Haworth Phenanthrene synthesis
Synthesis of 1,3,5-triethyl benzene.