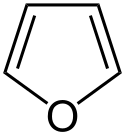
Furan
| Furan | |
|---|---|
 Strukturní vzorce furanu | |
| Obecné | |
| Systematický název | furan |
| Triviální název | fural |
| Ostatní názvy | furfuran, oxol, divinyloxid |
| Anglický název | Furan |
| Německý název | Furan |
| Sumární vzorec | C4H4O |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 110-00-9 |
| EC-no (EINECS/ELINCS/NLP) | 203-727-3 |
| Indexové číslo | 603-105-00-5 |
| SMILES | C1=CC=CO1 |
| Vlastnosti | |
| Molární hmotnost | 68,07 g/mol |
| Teplota tání | −85,6 °C |
| Teplota varu | 31,4 °C |
| Hustota | 0,936 g/cm³ |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H224 H350 H341 H332 H302 H373 H315 H412 EUH019 |
| R-věty | R45 R12 R19 R20/22 R38 R48/22 R52/53 R68 |
| S-věty | S53 S45 S61 |
Některá data mohou pocházet z datové položky. | |
Furan je heterocyklická organická látka, je to bezbarvá, vysoce těkavá kapalina vonící podobně jako chloroform, je toxický a může být karcinogenní. Katalytickou hydrogenací furanu za účasti katalyzátoru palladia vzniká tetrahydrofuran. Jeho nejčastější použití je v plastech.
Syntéza
- Furan lze připravit oxidací furfuralu a následnou dekarboxylací vzniklé furan-2-karboxylové kyseliny.
- Jednoduše ho lze připravit Paalovou–Knorrovou reakcí, kde 1,4-diketony (převážně enol-forma dialdehydu jantarového) reagují s oxidem fosforečným, za vzniku furanu a vody.
Fyzikální, chemické a biologické vlastnosti
Teplota varu furanu je blízko pokojové teplotě, konkrétně je to 31,4 °C, teplota tání je −85,6 °C.
Furan je rovinný útvar, který má vazby délky přibližně odpovídající průměru jednoduché a dvojné vazby. Má celkem šest π elektronů, z toho čtyři na atomech vodíku a dva na heteroatomech, což odpovídá Hücklevu pravidlu. Furan poskytuje svůj elektronový pár do konjugace mnohem méně ochotně než například síra či dusík, je elektronegativnější. To je také důvod proč je aromatický charakter furanu menší než u thiofenu či pyrrolu, což způsobuje nižší delokalizační energií. Na furanu může vzniknout řada mezomerních struktur, které jsou způsobeny nerovnoměrným rozložením elektronových hustot, nerovnoměrnost způsobuje heteroatom. Substituce bývá usměrňována do prvních dvou struktur, které mají náboje blízko u sebe.
Konzumace furanů může vést k poškození jater, toto riziko se, kvůli konzumaci hotových jídel ve sklenicích či konzervách, nejvíce týká kojenců. U dospělých jedinců je největším problémem, z hlediska furanů, konzumace potravin na bázi zrn, například: obiloviny, včetně kávy.
Výskyt a využití
Furan vzniká přirozeně při tepelném zpracování potravin. Má ho v sobě řada významných substituentů, jako je například vitamín C a některé sacharidy. Furan je též obsažen v dehtu z jedlového dřeva.
Samostatný furan nemá širší průmyslové využití, výjimkou je hydrogenace na tetrahydrofuran, ten se používá jako rozpouštědlo. Využití furanu je i v plastech.
Reakce
Furan vykazuje reakce charakteristické pro enolethery a adiční reakce typické pro dieny. Jsou však u něho popsány také elektrofilní substituční reakce.
Reakce za otevírání kruhu
Furan a jeho deriváty se snadno štěpí zředěnými kyselinami. Kyselina sírová podporuje vznik polymerních látek, zatímco kyselina chloristá ve vodném dimethysuldoxidu podporuje vznik sukcinaldehydu. Furan se protonuje v poloze dvě a následně dochází k tvorbě polymerů či butandialu (sukcinaldehyd). Přesněji primárně vznikne tetramethylacetal sukcinaldehydu, který poté hydrolýzou poskytne sukcinaldehyd. Reakci je vhodné provádět v suchém alkoholu, například v methanolu, se stopami chlorovodíku.
Podobně se štěpí i deriváty furanu, například reakcí kyseliny furylakrylové se suchým ethanolem a plynným chlorovodíkem dochází k esterifikaci a následně k otevírání kruhu. Poté vzniká, hydrolýzou primárně vzniklého diesteru, kyselina hydrochelidonová.
Adiční reakce
Příkladem adiční reakce je například furan reagující 1,4-adicí s bromem v methanolu. V reakci je přítomna báze octanu draselného, vzniká 2,5-dimethoxy-2,5-dihydrofuran.
Dalším příkladem jsou Dielsovy–Alderovy cykloadiční reakce. Furan reaguje naříklad s maleinanhydridem v acetonitrilu za vzniku bicyklických produktů. Při reakci je zapotřebí teplota 40 °C.
Dienovou adicí se vysvětluje nestálost furanu na vzduchu, protože při styku s kyslíkem dochází k adici kyslíku do poloh dvě a pět. Vzniká peroxid, který polymeruje radikálovým mechanismem na polymerní pryskyřice.
Další z řady adičních reakcí je nitrace furanu acetyl-nitrátem. Nitrace probíhá v bezvodném prostředí při teplotě mezi −10 °C a −20 °C. Vzniká 2-acetoxy-5-nitro-2,5-dihydrofuran, ze kterého, odštěpením kyseliny octové účinkem pyridinu, vzniká 2-nitrofuran.
Metalační reakce
Vodíky připojené na uhlíky v sousedství heteroatomu jsou slabě kyselé, je to způsobeno jednak přítomností elektronegativního heteroatomu a jednak nerovnoměrným rozložením elektronů v kruhu. Kyselost vodíků způsobuje to, že mezi furanem a organokovem probíhá acidobazická reakce. Například reakcí butyllithia v hexanu s furanem dochází k nahrazení vodíku za lithium. Vzniklé 2-furyllithium dále reaguje s různými elektrofilními činidly.
Elektrofilní substituce
Příkladem elektrofilní substituce je chlorace furanu, která probíhá při −40 °C a vznikají při ní polymerní produkty a směs halogenových derivátů. Jednou z možných reakcí je reakce dioxandibromidu při −5 °C, vzniká 2-bromfuran a v malém množství také 2,5-dibromfuran. Další reakcí je například reakce pyridinsulfotrioxidu s furanem za vzniku furan-2-sulfanové kyseliny, která se následně sulfonuje na furan-2,5-disulfonovou kyslinou.
Dalším příkladem elektrofilní substituce jsou Friedlovy–Craftsovy alkylace či acylace. Katalyzátorem v těchto reakcích je fluorid boritý nebo chlorid zinečnatý. Acylací furanu acetanhydridenu při 0 °C za katalýzy etherátem fluoridu boritého vzniká 2-acetylfuran.
Reference
- ↑ a b Furan. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- Červinka O., Dědek V., Ferles M.: Organická chemie, druhé přepracované vydání, 1980, SNTL, Praha
- Furan v potravinách - EFSA potvrzuje zdravotní rizika. Informační centrum bezpečnosti potravin [online]. 30.11.2017 [cit. 2022-02-17]. Dostupné z: https://www.bezpecnostpotravin.cz/furan-v-potravinach-efsa-potvrzuje-zdravotni-rizika.aspx
- Seznamte se: Furan - částice, která zabíjí. Moravskoslezský deník.cz [online]. 04.11.2011 [cit. 2022-02-17]. Dostupné z: https://moravskoslezsky.denik.cz/zpravy_region/seznamte-se-furan-castice-ktera-vas-nejspis-e2ad.html
- Furan. Chemie: Informace od A do Z [online]. 25.09.2015 [cit. 2022-02-17]. Dostupné z: http://chemie.g6.cz/?p=194
- KOZMÍK, Václav. Heterocyklické sloučeniny: Učební text pro výuku předmětu [online]. [cit. 2022-02-17]. Dostupné z: https://uoch.vscht.cz/files/uzel/0006592/Heterocyklicke_slouceniny.pdf?redirected
- Heterocyklické sloučeniny. Organická chemie: Pro gymnázia [online]. s. 87-90 [cit. 2022-02-17]. Dostupné z: http://www.e-chembook.eu/cz/organicka-chemie/Heterocyklicke-slouceniny.pdf
Externí odkazy
 Obrázky, zvuky či videa k tématu furan na Wikimedia Commons
Obrázky, zvuky či videa k tématu furan na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Structure of furan