Gilmanova činidla

Gilmanova činidla jsou organokovové sloučeniny lithia a mědi, s obecným vzorcem R2CuLi (R je alkyl nebo aryl). Jde o užitečnou skupinu reaktantů, protože na rozdíl od Grignardových a organolithných činidel reagují s halogenderiváty a nahrazují halogenové skupiny skupinami R;[1] tato reaktivita se využívá v Coreyových–Houseových syntézách, jež umožňují vytvářet složité sloučeniny z jednoduchých výchozích látek.[2]
Příprava a reakce
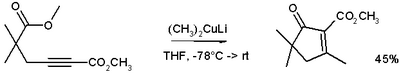
(CH3)2CuLi lze připravit reakcí jodidu měďného s methyllithiem v tetrahydrofuranu za teploty −78 °C. V níže znázorněné reakci[3] Gilmanovo činidlo methyluje alkyn prostřednictvím konjugované adice a záporný náboj je zachycen při nukleofilní acylové substituční reakci s esterem za vzniku cyklického enonu.
U konjugovaných enonů převažují 1,4-adice nad 1,2 adicemi.

Struktura
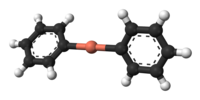
Dimethylměďnan lithný vytváří v diethyletheru dimer v podobě osmičlenné cyklické sloučeniny a obdobně krystalizuje jako dimerní etherát, [{Li(OEt2)}(CuPh2)]2.[4]


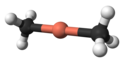
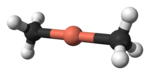
V komplexu s 12-crown-4 mají vzniklé diorganylměďnanové anionty na atomu mědi lineární koordinační geometrii.[5]
Smíšené měďnany
Obecnější využití než Gilmanova činidla mají smíšené měďnany, sloučeniny obsahující ionty [RCuX]− a [R2CuX]2−. Připravují se reakcemi organolithných sloučenin s měďnými halogenidy nebo kyanidem měďným. Vyznačují se větší stabilitou a snazším přečišťováním.[6] Jejich nevýhodou je využitelnost alkylové skupiny; někdy se tak používají smíšené měďnany typu Li2[Cu(2-thienyl)(CN)R] připravované z thienyllithia a kyanidu měďného a organickou skupinou, kterou má činidlo obsahovat. Nedochází zde k přesunu kyanidové ani thienylové skupiny.[7]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Gilman reagent na anglické Wikipedii.
- ↑ Henry Gilman; Reuben G. Jones; L. A. Woods. The Preparation of Methylcopper and some Observations on the Decomposition of Organocopper Compounds. Journal of Organic Chemistry. 1952, s. 1630–1634. doi:10.1021/jo50012a009.
- ↑ J. F. Normant. Organocopper(I) Compounds and Organocuprates in Synthesis. Synthesis. 1972, s. 63–80. doi:10.1055/s-1972-21833.
- ↑ Modern Organocopper Chemistry, N. Krause Ed. Wiley-VCH, 2002.
- ↑ N. P. Lorenzen; E. Weiss. Synthesis and Structure of a Dimeric Lithium Diphenylcuprate:[{Li(OEt)2}(CuPh2)]2. Angewandte Chemie International Edition. 1990, s. 300–302. doi:10.1002/anie.199003001.
- ↑ H. Hope; M. M. Olmstead; P. P. Power; J. Sandell; X. Xu. Isolation and x-ray crystal structures of the mononuclear cuprates [CuMe2]−, [CuPh2]−, and [Cu(Br)CH(SiMe3)2]−. Journal of the American Chemical Society. 1985, s. 4337–4338. doi:10.1021/ja00300a047.
- ↑ Steven H. Bertz, Edward H. Fairchild, Karl Dieter, "Copper(I) Cyanide" in Encyclopedia of Reagents for Organic Synthesis 2005, John Wiley & Sons doi:10.1002/047084289X.rc224.pub2
- ↑ Bruce H. Lipshutz, Robert Moretti, Robert Crow "Mixed Higher-order Cyanocuprate-induced Epoxide Openings: 1-Benzyloxy-4-penten-2-ol" Org. Synth. 1990, volume 69, pp. 80 doi:10.15227/orgsyn.069.0080
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Gilmanova činidla na Wikimedia Commons
Obrázky, zvuky či videa k tématu Gilmanova činidla na Wikimedia Commons
Média použitá na této stránce
Skeletal formula of a dimer from the crystal structure of lithium diphenylcuprate etherate, Ph2CuLi·2OEt2.
X-ray crystallographic data from Angew. Chem. Int. Ed. (1990) 29, 300-302.Ball-and-stick model of the dimethylcuprate anion, [Me2Cu]−, as found in the crystal structure of bis(12-crown-4)lithium dimethylcuprate, [Li(12-crown-4)2][Me2Cu].
X-ray crystallographic data from J. Am. Chem. Soc., 1985, 107 (14), pp 4337–4338.
Image generated in Accelrys DS Visualizer.Gilman reagent, Organic Chemistry
Stick model of a dimer from the crystal structure of lithium diphenylcuprate dietherate, Ph2CuLi·2OEt2.
X-ray crystallographic data from Angew. Chem. Int. Ed. (1990) 29, 300-302.Ball-and-stick model of the diphenylcuprate anion, [Ph2Cu]−, as found in the crystal structure of bis(12-crown-4)lithium diphenylcuprate, [Li(12-crown-4)2][Ph2Cu].
X-ray crystallographic data from J. Am. Chem. Soc., 1985, 107 (14), pp 4337–4338.
Image generated in Accelrys DS Visualizer.(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Gilman reaction example