Glutathion-S-transferáza
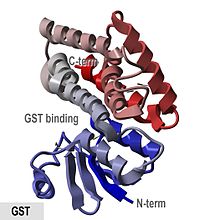
Glutathion S-transferáza (GST) je označení pro enzym známý pro svou schopnost katalyzovat konjugaci redukovaného glutathionu (GSH) s cizorodými toxickými substráty. Glutathion-S-transferázy se nachází v bakteriálních buňkách, ale i v buňkách eukaryotických organismů včetně člověka, kde slouží jako metabolické enzymy druhé fáze detoxikace. Dělí se do tří rodin – cytosolické, mitochondriální a mikrozomální.[1][2][3] Zástupci GST superrodiny vykazují značné odlišnosti v aminokyselinové sekvenci a velké množství sekvencí GST ve veřejných databázích má stále neznámou funkci.[4]
V některých orgánech savců může GST představovat až 10 % celkových proteinů.[5][6] GST katalyzují konjugaci glutathionu přes sulfhydrylovou skupinu s elektrofilními centry na rozmanitých substrátech; navázáním glutathionu se tyto substráty stávají více rozpustnými ve vodě.[7][8] Dochází tak k detoxifikaci nejen tělních odpadních látek, jako jsou peroxidované lipidy, ale i k odstranění xenobiotik, tedy látek cizorodé povahy, z těla. GST také může vyvazovat jedovaté látky a fungovat jako transportní protein, což vedlo k ranému názvu pro GST – ligandin.[9][10]
Klasifikace
GST se na základě proteinové sekvence a struktury třídí do tří superrodin - cytosolické, mitochondriální a mikrozomální (MAPEG) GST. .Cytosolické GST jsou poměrně konzervované a obvykle mívají vzájemně až 40% sekvenční homologii. To neplatí pro mitochondriální a mikrozomální GST, které jsou velmi rozrůzněné a vzájemně nepodobné. Cytosolické GST se podle struktury dělí do 13 tříd: alfa, beta, delta, epsilon, zeta, theta, mu, nu, pi, sigma, tau, phi a omega. Mitochondriální GST představují třídu kappa a mikrozomální GST se dělí do čtyř podskupin I-IV. V lidském těle se vyskytují GST tříd alfa, zeta, theta, mu, pi, sigma a omega a dále šest isozymů z tříd I, II a IV mikrozomálních GST.[8][11][12]
Struktura
Glutathion-vazebné místo (G-místo) se nachází v thioredoxin-like doméně cytosolických i mitochondriálních GST enzymů. Oblast helixu α2 vykazuje při srovnávání různých GST největší rozmanitost a je místem, které kontaktuje glycinový zbytek glutathionu. Aminokyselinou, která glycin glutathionu kontaktuje, je u části GST tyrosin, u části serin či cystein.[8][13] Savčí cytosolické GST jsou dimerní a obě podjednotky patří vždy do stejné třídy GST, ale nemusí být nutně zcela identické. Monomerní GST má velikost asi 25 kDa.[11][14]
Funkce
GST není funkční bez stálého přísunu GSH, tedy redukovaného glutathionu. Ten vzniká činností gamma-glutamylcystein-syntetázy a glutathionsyntázy. Důležité jsou i přenašeče, které z buňky odstraňují již konjugované látky z buňky ven. Primární funkcí GST je katalyzovat nukleofilní atak glutathionem na elektrofilní uhlík, síru nebo dusík na molekulách nepolárních cizorodých látek. Tím brání tomu, aby takové látky např. poškozovaly správnou funkci buněčných proteinů nebo nukleových kyselin, na které se mohou vázat.[12][15] K substrátům GST patří i různé jedovaté či škodlivé látky běžné v životním prostředí člověka, jako chemoterapeutika a jiná léčiva, pesticidy, herbicidy, karcinogenní látky či různé epoxidy. GST mimo jiné detoxifikuje β1-8,9-epoxid vznikající v těle krys z aflatoxinu B1, což jim umožňuje být proti tomuto jedu v plesnivých potravinách být imunní.[15] Pro stanovení funkčnosti savčích GST se používá substrát 1-chloro-2,4-dinitrobenzen.[16] Naopak látkou inhibující funkci GST je mimo jiné bilirubin. Platí, že lidské GST izoformy se zpravidla vyskytují přísně v určitých orgánech či buněčných typech – např. alfa GST je v jaterních buňkách a pí GST je ve žlučovodech.[17]
Zajímavostí je, že se GST účastní i buněčné signalizace, a to díky své schopnosti vázat se na nesubstrátové ligandy (tedy látky, které není schopna metabolizovat). Mohou tak inhibovat např. funkci některých kináz v MAP kinázové dráze[18] nebo JNK kinázy účastnící se spouštění apoptózy.[18]
GST enzymy zřejmě hrají důležitou roli ve vzniku rakoviny i rezistence ke chemoterapeutikům.[19] Některé alely GST enzymů mají vliv na vznik astmatu, aterosklerózy, alergie či dalších zánětlivých onemocnění.[15] Diabetes je nemoc doprovázená oxidativním poškozením tkání a u mnoha pacientů nefunguje glutathionový metabolismus tak, jak by měl.[20] Oxidativní poškození spojuje GST (třídy omega) i s neurologickými nemocemi, jako je Alzheimerova choroba, Parkinsonova nemoc či amyotrofická laterální skleróza.[21] GST jsou také mimoděk dobrými markery poškození jednotlivých orgánů – pokud jejich hladiny v určitých orgánech klesají, něco je s ním špatně. To je výhodné pro diagnostiku např. poškození jater při transplantaci, u otrav či virových infekcí.[22][23][24]
GST-tagování a izolace proteinů
GST enzym se používá ve vědeckém výzkumu. Je možné je přidat jako tag k proteinu, který výzkumník zkoumá, a následně je ho možné vyizolovat pomocí pull-down purifikace. Prvním krokem je připojení DNA kódující GST ke kódující sekvenci genu, který kóduje protein, který chceme otagovat. Po expresi takového fúzního genu získáváme buněčný lyzát s tímto GST-fúzním proteinem. GST protein má velmi silnou afinitu k glutathionu a pokud do proteinového lyzátu přidáme např. na agarózových kuličkách, můžeme tímto způsobem vyizolovat čistý GST-tagovaný protein.[25][26] V určitých případech je možné GST tag i odstranit, aby neinterferoval s funkcí proteinu.[25][27]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Glutathione S-transferase na anglické Wikipedii.
- ↑ Udomsinprasert R, Pongjaroenkit S, Wongsantichon J, Oakley AJ, Prapanthadara LA, Wilce MC, Ketterman AJ. Identification, characterization and structure of a new Delta class glutathione transferase isoenzyme. Biochem. J.. June 2005, s. 763–71. DOI 10.1042/BJ20042015. PMID 15717864.
- ↑ Sheehan D, Meade G, Foley VM, Dowd CA. Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily. Biochem. J.. November 2001, s. 1–16. DOI 10.1042/0264-6021:3600001. PMID 11695986.
- ↑ Allocati N, Federici L, Masulli M, Di Ilio C. Glutathione transferases in bacteria. FEBS J.. January 2009, s. 58–75. DOI 10.1111/j.1742-4658.2008.06743.x. PMID 19016852.
- ↑ ATKINSON, HJ; BABBITT, PC. Glutathione transferases are structural and functional outliers in the thioredoxin fold.. Biochemistry. Nov 24, 2009, s. 11108–16. DOI 10.1021/bi901180v. PMID 19842715.
- ↑ Boyer TD. The glutathione S-transferases: an update. Hepatology. March 1989, s. 486–96. DOI 10.1002/hep.1840090324. PMID 2646197.
- ↑ Mukanganyama S, Bezabih M, Robert M, et al. The evaluation of novel natural products as inhibitors of human glutathione transferase P1-1. J Enzyme Inhib Med Chem. August 2011, s. 460–7. DOI 10.3109/14756366.2010.526769. PMID 21028940.
- ↑ Douglas KT. Mechanism of action of glutathione-dependent enzymes. Adv. Enzymol. Relat. Areas Mol. Biol.. 1987, s. 103–67. PMID 2880477.
- ↑ a b c Oakley A. Glutathione transferases: a structural perspective. Drug Metab. Rev.. May 2011, s. 138–51. Dostupné online. DOI 10.3109/03602532.2011.558093. PMID 21428697.
- ↑ Leaver MJ, George SG. A piscine glutathione S-transferase which efficiently conjugates the end-products of lipid peroxidation. Marine Environmental Research. 1998, s. 71–74. DOI 10.1016/S0141-1136(97)00071-8.
- ↑ Litwack G, Ketterer B, Arias IM. Ligandin: a hepatic protein which binds steroids, bilirubin, carcinogens and a number of exogenous organic anions. Nature. December 1971, s. 466–7. DOI 10.1038/234466a0. PMID 4944188.
- ↑ a b Eaton DL, Bammler TK. Concise review of the glutathione S-transferases and their significance to toxicology. Toxicol. Sci.. June 1999, s. 156–64. Dostupné online. DOI 10.1093/toxsci/49.2.156. PMID 10416260.
- ↑ a b Josephy PD. Genetic variations in human glutathione transferase enzymes: significance for pharmacology and toxicology. Hum Genomics Proteomics. 2010, s. 876940. Dostupné v archivu pořízeném dne 2020-04-26. DOI 10.4061/2010/876940. PMID 20981235. Archivovaná kopie. hgp.sagepub.com [online]. [cit. 2014-10-18]. Dostupné v archivu pořízeném z originálu.
- ↑ Atkinson HJ, Babbitt PC. Glutathione transferases are structural and functional outliers in the thioredoxin fold. Biochemistry. November 2009, s. 11108–16. DOI 10.1021/bi901180v. PMID 19842715.
- ↑ Landi S. Mammalian class theta GST and differential susceptibility to carcinogens: a review. Mutat. Res.. October 2000, s. 247–83. DOI 10.1016/s1383-5742(00)00050-8. PMID 11018744.
- ↑ a b c Hayes JD, Flanagan JU, Jowsey IR. Glutathione transferases. Annu. Rev. Pharmacol. Toxicol.. 2005, s. 51–88. Dostupné online. DOI 10.1146/annurev.pharmtox.45.120403.095857. PMID 15822171.
- ↑ Habig WH, Pabst MJ, Fleischner G, Gatmaitan Z, Arias IM, Jakoby WB. The Identity of Glutathione S-Transferase B with Ligandin, a Major Binding Protein of Liver. Proc. Natl. Acad. Sci. U.S.A.. October 1974, s. 3879–82. DOI 10.1073/pnas.71.10.3879. PMID 4139704.
- ↑ Beckett GJ, Hayes JD. Glutathione S-transferase measurements and liver disease in man. Journal of Clinical Biochemistry and Nutrition. 1987, s. 1–24. DOI 10.3164/jcbn.2.1.
- ↑ a b Laborde E. Glutathione transferases as mediators of signaling pathways involved in cell proliferation and cell death. Cell Death Differ.. September 2010, s. 1373–80. DOI 10.1038/cdd.2010.80. PMID 20596078.
- ↑ Tew KD, Manevich Y, Grek C, Xiong Y, Uys J, Townsend DM. The role of glutathione S-transferase P in signaling pathways and S-glutathionylation in cancer. Free Radic. Biol. Med.. July 2011, s. 299–313. Dostupné online. DOI 10.1016/j.freeradbiomed.2011.04.013. PMID 21558000.
- ↑ Franco R, Schoneveld OJ, Pappa A, Panayiotidis MI. The central role of glutathione in the pathophysiology of human diseases. Arch. Physiol. Biochem.. 2007, s. 234–58. DOI 10.1080/13813450701661198. PMID 18158646.
- ↑ Board PG. The omega-class glutathione transferases: structure, function, and genetics. Drug Metab. Rev.. May 2011, s. 226–35. DOI 10.3109/03602532.2011.561353. PMID 21495794.
- ↑ Hughes VF, Trull AK, Gimson A, Friend PJ, Jamieson N, Duncan A, Wight DG, Prevost AT, Alexander GJ. Randomized trial to evaluate the clinical benefits of serum alpha-glutathione S-transferase concentration monitoring after liver transplantation. Transplantation. November 1997, s. 1446–52. DOI 10.1097/00007890-199711270-00013. PMID 9392310.
- ↑ Beckett GJ, Chapman BJ, Dyson EH, Hayes JD. Plasma glutathione S-transferase measurements after paracetamol overdose: evidence for early hepatocellular damage. Gut. January 1985, s. 26–31. DOI 10.1136/gut.26.1.26. PMID 3965363.
- ↑ Loguercio C, Caporaso N, Tuccillo C, Morisco F, Del Vecchio Blanco G, Del Vecchio Blanco C. Alpha-glutathione transferases in HCV-related chronic hepatitis: a new predictive index of response to interferon therapy?. J. Hepatol.. March 1998, s. 390–5. DOI 10.1016/s0168-8278(98)80311-5. PMID 9551675.
- ↑ a b Benard V, Bokoch GM. Assay of Cdc42, Rac, and Rho GTPase activation by affinity methods. Meth. Enzymol.. 2002, s. 349–59. DOI 10.1016/s0076-6879(02)45028-8. PMID 11665618.
- ↑ Ren L, Chang E, Makky K, Haas AL, Kaboord B, Walid Qoronfleh M. Glutathione S-transferase pull-down assays using dehydrated immobilized glutathione resin. Anal. Biochem.. November 2003, s. 164–9. DOI 10.1016/j.ab.2003.07.023. PMID 14596823.
- ↑ Tinta T, Christiansen LS, Konrad A, et al. Deoxyribonucleoside kinases in two aquatic bacteria with high specificity for thymidine and deoxyadenosine. FEMS Microbiol. Lett.. June 2012, s. 120–7. DOI 10.1111/j.1574-6968.2012.02565.x. PMID 22462611.
Externí odkazy
 Obrázky, zvuky či videa k tématu Glutathion-S-transferáza na Wikimedia Commons
Obrázky, zvuky či videa k tématu Glutathion-S-transferáza na Wikimedia Commons - (anglicky) Tabulka známých glutathione-S-transferáz
- (anglicky) Příprava GST-fúzních proteinů
- (anglicky) Příručka - Příprava GST-fúzních proteinů Archivováno 5. 12. 2008 na Wayback Machine.
Média použitá na této stránce
PDB: 1R5A. Glutathione S-Transferase; Chain: A [Ec: 2.5.1.18]. Exp. Method: X-ray Diffraction by Oakley, A. J. visualized by Kosi Gramatikoff using ICM Browser Pro.
