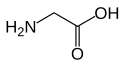
Glycin
| Glycin | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | Aminoethanová kyselina |
| Triviální název | Glycin |
| Sumární vzorec | C2H5NO2 |
| Identifikace | |
| Registrační číslo CAS | 56-40-6 |
| Vlastnosti | |
| Molární hmotnost | 75,07 g/mol |
| Teplota tání | 232–236 °C |
| Teplota varu | > 230 °C (rozklad) |
| Hustota | 1,595 g/cm3 |
| Disociační konstanta pKa | pKCOOH: 2,4 pKNH2: 9,8 |
| Izoelektrický bod | 5,97 |
| Průměrný výskyt | (v proteinech) 7,2 % |
Některá data mohou pocházet z datové položky. | |
Glycin (Gly, G) je aminokyselina s nepolárním postranním řetězcem. Na rozdíl od ostatních nepolárních aminokyselin (Ala, Val, Leu, Ile, Pro, Met, Phe, Trp) však není jeho celkový charakter příliš nepolární. Jedná se o nejjednodušší z 23 proteinogenních aminokyselin: Glycin jako jediná biogenní aminokyselina není opticky aktivní, neboť kvůli přítomnosti dvou vodíků na α uhlíku má rovinu symetrie (nemůže se tedy rozlišit D- a L-glycin). Z důvodu krátkého postranního řetězce se může glycin vázat na místa, na která jiné aminokyseliny ze sterických důvodů nemohou. Například pouze glycin může být vnitřní aminokyselinou kolagenové šroubovice.
Glycin je velmi evolučně stabilní na důležitých místech některých proteinů (například, v cytochromu c, myoglobinu, a hemoglobinu), neboť mutace měnící tuto aminokyselinu za jinou s větším postranním řetězcem výrazně pozměňují strukturu proteinu. Dalším příkladem je aktivní centrum proteázy chymotrypsinu, který štěpí enzymy za objemnými aminokyselinami typu fenylalanin, tryptofan, tyrosin, a proto i tady má záměna glycinu vážné důsledky. Enzym neschopný katalýzy je vyřazen z činnosti v proteazomu.
Glycin má stejný sumární vzorec jako nitroethan.
Většina proteinů obsahuje relativně malé množství glycinu. Důležitou výjimkou je kolagen, který se skládá z glycinu z jedné třetiny.[1] Důvod spočívá v tom, že další přibližně třetinu kolagenního vlákna zaujímá lysin a hydroxylysin. Obě tyto aminokyseliny mají omezené možnosti rotace a glycin tak vyrovnává deformační vliv těchto aminokyselin na strukturu kolagenního vlákna.
Ve velkém množství se glycin nachází také v elastinu.
Kódují ho kodóny GGU, GGC, GGA a GGG.
Fyziologické účinky
Glycin je inhibiční neuropřenašeč v CNS, obzvláště v míše, mozkovém kmeni a v sítnici. V míše je většina inhibičních interneuronů glycinergních. Aktivací glycinových ionotropních receptorů na postsynaptické membráně se otevírají iontové kanály a chloridové ionty vstupují do neuronu, což působí hyperpolarizaci a takzvaný inhibiční postsynaptický potenciál (IPSP). Strychnin je antagonista ionotropních glycinových receptorů. Glycin je společně s glutamátem ligandem (konagonista) NMDA receptorů. Na rozdíl od inhibičních účinků v míše, např. inhibice antagonistických svalů v reflexních obloucích, na NMDA glutaminergních receptorech má glycin účinky excitační. LD50 glycinu je 7930 mg/kg pro potkana (orálně) a smrt je způsobena hyperexcitabilitou nervové soustavy.
Biosyntéza
Glycin není esenciální aminokyselina, to znamená, že tělo si je schopné syntetizovat potřebné množství samo bez nutnosti jeho výskytu v potravě. Biosyntéza probíhá z aminokyseliny serin, který je vyráběn z 3-fosfoglycerátu. U většiny organismů tuto reakci katalyzuje enzym serin hydroxymethyltransferáza s pomocí kofaktoru pyridoxalfosfátu (pyridoxal je druh vitamínu B6).[2]
- serin + tetrahydrofolát → glycin + 5,10-methylentetrahydrofolát + H2O
V játrech obratlovců je syntéza glycinu katalyzována enzymem glycinsyntáza (neboli GDC – komplex glycin dekarboxylázy). Tato reakce je reverzibilní:[2]
- CO2 + NH4+ + 5,10-methylentetrahydrofolát + NADH + H+ → Glycine + tetrahydrofolát + NAD+
Degradace
Glycin je degradován třemi různými cestami. V živočiších převažuje cesta skrze enzym glycindekaboxyláza (stejný enzym jako ten účastnící se biosyntézy). Tato cesta je zpětná reakce biosyntézy:[2]
- Glycine + tetrahydrofolát + NAD+ → CO2 + NH4+ + 5,10-methylentetrahydrofolát + NADH + H+
Druhá cesta je dvoukroková. První krok je zpětná reakce biosyntézy z serinu enzymem serinhydroxymethyltransferáza. Serin je pak přeměněn na pyruvát enzymem serin dehydratáza.[2]
Ve třetí cestě je glycin přeměněn na glyoxylát pomocí D-aminokyselina oxidázy. Glyoxylát je pak oxidován jaterní laktát dehydrogenázou na oxalát v NAD+-závislé reakci.[2]
Přítomnost v mezihvězdném prostoru
V roce 1994 skupina astronomů z University of Illinois v Urbana-Champaign vedená Lewisem Snyderem ohlásila objev molekul glycinu ve vesmírném prostoru. Následujícími analýzami se ukázalo, že tento objev nemůže být potvrzen. O devět let později, v r. 2003, Yi-Jehng Kuan z National Taiwan Normal University a Steve Charnley detekovali mezihvězdný glycin ve třech zdrojích mezihvězdné hmoty. Ohlásili identifikaci 27 pásů glycinu pomocí radioteleskopu.[3] Podle počítačových simulací a laboratorních experimentů, vznikl glycin pravděpodobně tak, že ledové částice obsahující jednoduché organické molekuly byly vystaveny ultrafialovému záření. V říjnu 2004 Snyder a spolupracovníci znovu přezkoumali Kuanův objev glycinu. Snyder dokázal, že glycin nebyl ani v jednom ze tří zdrojů správně detekován.
Odkazy
Reference
- ↑ Lodish H, Berk A, Zipursky SL, et al. Molecular Cell Biology. 4th edition. New York: W. H. Freeman; 2000. Section 22.3, Collagen: The Fibrous Proteins of the Matrix. Available from: http://www.ncbi.nlm.nih.gov/books/NBK21582/
- ↑ a b c d e NELSON, David L.; COX, Michael M. Principles of Biochemistry. New York: W. H. Freeman, 2005. Dostupné online. ISBN 0-7167-4339-6. S. 127, 675–77, 844, 854.
- ↑ KUAN, Yi‐Jehng; CHARNLEY, Steven B.; HUANG, Hui‐Chun. Interstellar Glycine. The Astrophysical Journal. 2003-08-20, roč. 593, čís. 2, s. 848–867. Dostupné online [cit. 2024-05-30]. ISSN 0004-637X. DOI 10.1086/375637. (anglicky)
Literatura
- Snyder LE, Lovas FJ, Hollis JM, et al. (2005) A rigorous attempt to verify interstellar glycine. ASTROPHYS J 619 (2): 914-930
- https://web.archive.org/web/20071020054638/http://physchem.ox.ac.uk/MSDS/GL/glycine.html Safety (MSDS) data for glycine, 2005, The Physical and Theoretical Chemistry Laboratory Oxford University, datum přístupu: 2006-11-01.
- Dawson, R.M.C., Elliott, D.C., Elliott, W.H., and Jones, K.M., Data for Biochemical Research (3rd edition), pp. 1-31 (1986)
- http://www.newscientist.com/news/news.jsp?id=ns99992558 www.newscientist.com
Externí odkazy
 Obrázky, zvuky či videa k tématu glycin na Wikimedia Commons
Obrázky, zvuky či videa k tématu glycin na Wikimedia Commons - PDRHealth - Glycine
- Computational Chemistry Wiki
- Glycine cleavage system
Média použitá na této stránce
Zjednodušený racionální konstituční vzorec glycinu.