Glykogenfosforyláza
Glykogenfosforyláza (někdy prostě „fosforyláza“[1]) je enzym ze skupiny transferáz, který katalyzuje první krok rozkladu glykogenu. Název je odvozen od skutečnosti, že přenáší anorganickou fosfátovou skupinu na glukózové podjednotky glykogenu za vzniku glukóza-1-fosfátů. Tento enzym vyžaduje celou řadu pomocných kofaktorů a je dále pečlivě regulován, čímž se stává ústředním bodem metabolismu glykogenu (a vůbec sacharidů) v živočišné buňce.
Struktura
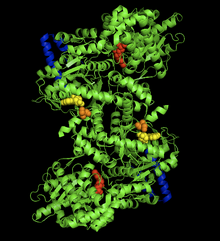
Glykogenfosforyláza je ve skutečnosti dimer dvou identických podjednotek (tedy homodimer), každá o velikosti 97 kDa (Mr 97 000), 842 aminokyselin.[1] Přesná struktura se liší v rámci jednotlivých tkání a u člověka jsou tedy známy tři izoformy, v játrech, svalech a mozku.[2] Bez ohledu na izoformu však glykogenfosforyláza prochází zásadními strukturními změnami po fosforylaci svého serinu na pozici 14. Enzym s fosfátem na této pozici se označuje jako fosforyláza a a je to za normálních okolností plně aktivní enzym schopný rozkladu glykogenu. Enzym defosforylovaný se označuje jako fosforyláza b.[1]
Na molekulu glykogenfosforylázy se však váže celá řada dalších molekul: pro katalytickou aktivitu je zásadní hlavně pyridoxal-5-fosfát (vitamín B6), inhibují ji ATP, glukóza-6-fosfát a glukóza a aktivuje ji AMP.[1]
Mechanismus
Glykogenfosfororyláza štěpí glukózové podjednotky od neredukujících konců glykogenové molekuly.[1]
Regulace

Glykogenfosforyláza je pod přísnou kontrolou celé řady mechanismů, které zpravidla ovlivňují přechod mezi fosforylázou b a fosforylázou a, případně přechod mezi R a T stavy enzymů. Přechod R/T způsobuje vazba různých alosterických regulátorů, uvedených výše - aktivátory navozují R stav, inhibitory T stav.
Přechod mezi fosforylázami „b“ a „a“, který je zpravidla za normálního stavu v buňkách důležitější, způsobuje fosforylace enzymu na pozici Ser14. Fosforylaci katalyzuje fosforyláza-kináza (kináza fosforylázy), zpětnou reakci katalyzuje fosfoproteinfosfatáza I. Existují však i vyšší úrovně regulace glykogenfosforylázy. Např. fosforyláza-kináza je aktivní pouze tehdy, je-li sama fosforylována. Tuto fosforylaci způsobuje cAMP-dependentní proteinkináza (tzv. proteinkináza A). Naopak fosfoproteinfosfatázu I inhibuje tzv. inhibitor fosfoproteinfosfatázy. Tento inhibitor je dále sám pod kontrolou dalších enzymů - aktivuje ho cAMP-dependentní proteinkináza, inhibuje ho fosfoproteinfosfatáza I. Je tedy zřejmé, že regulace aktivity glykogenfosforylázy je velmi komplexní. Navíc je známo, že je úzce provázána s glykogensyntázou, tedy enzymem s opačnou rolí (vytvářet glykogen) – zhruba platí, že je-li glykogenfosforyláza aktivována, glykogensyntáza zůstává „vypnutá“.[1]
Na nejvyšší úrovni je glykogenfosforyláza regulována převážně hladinou cAMP, která následně spouští nebo nespouští proteinkinázu A. cAMP se zvyšuje díky aktivaci adenylátcyklázy, a to například působením hormonů glukagonu či adrenalinu. Při nízkých hladinách glukózy v krvi je možné tímto způsobem rozkládat jaterní glykogen a vzniklý glukóza-6-fosfát přeměňovat pomocí glukóza-6-fosfatázy na glukózu, který odchází do krve.[1]
Onemocnění
Nějakým způsobem nefunkční svalová glykogenfosforyláza může způsobovat McArdleovu chorobu, zatímco mutovaná jaterní fosforyláza má na svědomí Hersovu chorobu.[2]
Reference
Externí odkazy
 Obrázky, zvuky či videa k tématu Glykogenfosforyláza na Wikimedia Commons
Obrázky, zvuky či videa k tématu Glykogenfosforyláza na Wikimedia Commons
Média použitá na této stránce
The glycogen phosphorylase R and T states of the tower helices on the left and right respectively.
Glycogen Phosphorylase Dimer with Glycogen Binding Site, AMP Allosteric Site, Ser14, and Catalytic Site Labeled
Action of glycogen phosphorylase on glycogen
Autor: Yikrazuul, Licence: CC BY-SA 3.0
regulation of glycogen metabolism (glycogenolysis), initiiated by glucagon or epinephrine