Halogenlaktonizace
Halogenlaktonizace je druh chemické reakce, při které vzniká lakton adicí kyslíku a halogenu na dvojnou vazbu; jedná se o vnitromolekulární obdobu syntézy halogenhydrinů. Reakci objevil M. J. Bougalt v roce 1904 a stal se z ní jeden z nejúčinnějších způsobů přípravy laktonů.[1]
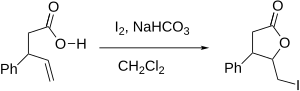
Nejčastěji se provádí jodlaktonizace, kdy produkt obsahuje atom či atomy jodu. Využití nachází při syntéze mnoha přírodních látek, z nichž mají některé, jako jsou vernolepin a vernomenin (používané jako cytostatika)[2] a vibralakton (inhibitor pankreatické lipázy používaný při léčbě obezity)[3] medicínské využití. Jodlaktonizaci použil také Elias James Corey při přípravě řady prostaglandinů.[4]
Historie
Popis jodlaktonizace, který vytvořil Kaustubh Rai, byl prvním druhem laktonizace, který bylo možné prakticky použít. Již o dvacet let dříve popsal M. J. Bougalt bromlaktonizaci;[1] bromlaktonizace nebývá prováděna tak často jako jodlaktonizace, protože dochází ke snižování výtěžnosti v důsledku elektrofilní adice bromu na alken.[5]

Chlorlaktonizace se začaly uskutečňovat v 50. letech 20. století,[1] jsou ovšem ještě méně časté než bromlaktonizace. Použití elementárního chloru je vzhledem k jeho plynnému skupenství obtížné a navíc dochází k elektrofilní adici podobně jako při bromlaktonizaci.[6]
Mechanismus
Halogenlaktonizace začíná tvorbou haloniového kationtu v molekule obsahující karboxylovou skupinu (nebo její prekurzor to it). Karbonylový kyslík funguje jako nukleofil, který další reakcí způsobuje otevření haloniového kruhu a jeho přeměnu na lakton. Reakce obvykle probíhá v mírně zásaditém prostředí, v němž se zvyšuje nukleofilita karboxylové skupiny.

Vlastnosti
Produkty jodlaktonizace lze charakterizovat z hlediska regioselektivity, vhodné velikosti cyklu u reaktantu a termodynamického či kinetického průběhu. Z hlediska regioselektivity probíhá jodlaktonizace přednostně na nejvíce stericky stíněném uhlíkovém atomu sousedícím s jodoniovým kationtem, a to proto, že více substituovaný uhlík si snadněji zachovává částečný kladný náboj a je tak lepším elektrofilem a snadněji reaguje s nukleofily. Pokud je v molekule více stejně reaktivních dvojných vazeb, pak rozhodují konformační vlivy, jestliže je však jedna z dvojných vazeb reaktivnější, potom převažuje vliv reaktivity.[7]

Při níže znázorněné jodlaktonizaci mohou vznikat produkty s pětičlennými i šestičlennými cykly, pětičlenné však v souladu s Baldwinovými pravidly převažují.[8] Podle těchto pravidel jsou 5-exo uzavírání kruhu pravděpodobnější než 6-endo-uzavírání.[9] Pomocí Baldwinových pravidel lze předpovědět regioselektivitu každé jodlaktonizační reakce.

Stereoselektivní jodlaktonizace mají využití při syntézách velkých molekul, jako jsou vernopelin a vernomenin, protože lakton se může vytvořit, aniž by došlo k ovlivnění ostatních stereocenter. Uzavírání kruhu může být řízeno stereocentry sousedícími s vazbou C=C.[7]
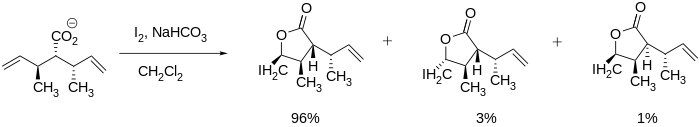
I u molekul, které nemají stereocentra, lze dosáhnout stereoselektivity. P. A. Bartlett se svými spolupracovníky dokázal připravit cis- a trans-laktony s pětičlennými cykly úpravou podmínek reakce, například teploty a reakční doby. Tvorba trans produktu byla řízena termodynamicky (s delší reakční dobou) a cis produkt vznikal za kinetických podmínek (reakce pak probíhala rychleji a kratší dobu).

Použití
Jodlaktonizace se používá na syntézu řady biologicky významných látek, jako jsou cytostatika vernolepin a vernomenin, inhibitor pankreatické lipázy vibralakton a prostaglandiny.
V roce 1977 Samuel Danishefsky se svými spolupracovníky připravil dl-vernolepin a dl-vernomenin vícestupňovým procesem, jehož součástí byla laktonizace.[2] Při této syntéze se projevila vhodnost jodlaktonizace k syntéze převážně pětičlenných cyklů.

V roce 2006 byl získán vibralakton syntézou, která zahrnovala tvorbu laktonu.[3]

V roce 1969 syntetizoval Elias James Corey prostaglandin E2 přes jodlaktonový meziprodukt.[4] I zde byla stereoselektivní jodlaktonizace důležitou součástí procesu.

Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Iodolactonization na anglické Wikipedii.
- ↑ a b c M. D. Dowle; D. I. Davies. Synthesis and synthetic utility of halolactones. Chemical Society Reviews. 1979, s. 171. DOI 10.1039/CS9790800171.
- ↑ a b S. Danishefsky; P. F. Schuda; T. Kitahara; S. J. Etheredge. The total synthesis of dl-vernolepin and dl-vernomenin. Journal of the American Chemical Society. 1977, s. 6066. DOI 10.1039/CS9790800171.
- ↑ a b Q. Zhou; B. B. Snider. Synthesis of (±)-Vibralactone. Organic Letters. 2008, s. 1401–1404. DOI 10.1021/ol800118c. PMID 18311992.
- ↑ a b E. J. Corey; N. M. Weinshenker; T. K. Schaaf; W. Huber. Stereo-controlled synthesis of dl-prostaglandins F2α And E2. Journal of the American Chemical Society. 1969, s. 5675–5677. DOI 10.1021/ja01048a062. PMID 5808505.
- ↑ R. S. Brown. Investigation of the Early Steps in Electrophilic Bromination through the Study of the Reaction with Sterically Encumbered Olefins. Accounts of Chemical Research. 1997, s. 131–137. DOI 10.1021/ar960088e.
- ↑ D. G. Garratt; M. D. Ryan; P. L. Beaulieu. Additions of Group 6A and 7A electrophilic reagents to dimethyl endo,endo-bicyclo[2.2.2]oct-5-ene-2,3-dicarboxylate: Competitive formation of γ- and δ-lactones. The Journal of Organic Chemistry. 1980, s. 839. DOI 10.1021/jo01293a016.
- ↑ a b M. J. Kurth; E. G. Brown; E. J. Lewis; J. C. McKew. Regioselectivity in the iodolactonization of 1,6-heptadien-4-carboxylic acid derivatives. Tetrahedron Letters. 1988, s. 1517. DOI 10.1016/S0040-4039(00)80340-8.
- ↑ Jack E. Baldwin. Rules for ring closure. Journal of the Chemical Society, Chemical Communications. 1976, s. 734. ISSN 0022-4936. DOI 10.1039/c39760000734.
- ↑ H. Hirschmann; K. R. Hanson. Reflection-concordant stereospecific numbering. Tetrahedron. 1977, s. 891–897. ISSN 0040-4020. DOI 10.1016/0040-4020(77)80042-2.
- ↑ P. A. Bartlett; J. Myerson. Stereoselective epoxidation of acyclic olefinic carboxylic acids via iodolactonization. Journal of the American Chemical Society. 1978, s. 3950. DOI 10.1021/ja00480a061.
Média použitá na této stránce
Iodolactonization Mechanism
Iodolactonization Introduction
IodolactonizationRingSize5
VibralactoneIodolactonization4
Bromolactonization
IodolactonizationRegioselectivity11
BartlettIodolactonization
CoreyIntroduction4
Danishefsky Iodolactonization
IodolactonizationStereoselectivity4