Halotan
| Halotan | |
|---|---|
 | |
| Název (INN) | halothane (angličtina) |
| Kódy | |
| Číslo CAS | 151-67-7 |
| ChEMBL ID | CHEMBL931 |
| ChemSpider ID | 3441 |
| PubChem | 3562 |
| Chemie | |
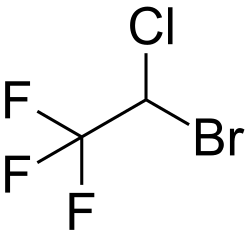
| Sumární vzorec | C₂HBrClF₃ |
| SMILES | C(C(F)(F)F)(Cl)Br |
| InChI | InChI=1S/C2HBrClF3/c3-1(4)2(5,6)7/h1H |
| Molární hmotnost | 195,890 224 Da |
| Teplota tání | −180 °F |
| Teplota varu | 122 °F |
| Hustota | 1,87 g/cm³ |
| Farmakologie | |
| Indikace | status asthmaticus a astma |
| Cesty podání | inhalační podání |
| Některá data mohou pocházet z datové položky. | |
Halotan (INN; též halothan, anglicky halothane), je uhlovodíkový halogenderivát používaný jako inhalační celkové anestetikum. Systematický název sloučeniny je 2-brom-2-chlor-1,1,1-trifluorethan, látka je známa i pod obchodním názvem Fluothane. Jedná se o jediné inhalační anestetikum, které obsahuje v molekule atom bromu; existuje řada jiných halogenovaných anestetik, která obsahují atomy chloru a fluoru (jako v případě halotanu), ale atom bromu postrádají. Halotan je bezbarvá, na světle nestabilní, kapalina příjemné, mentolo-peprmintové vůně (podobně jako Alpa). Dodává se v hnědých láhvích a obsahuje 0,01 % thymolu jakožto stabilizačního činidla. Halotan patří mezi základní léčiva obsažená v seznamu WHO.[1] Používání halotanu ve vyspělých státech však bylo téměř úplně překonáno novějšími inhalačními anestetiky.
Příbuzné látky
Halotan není chemicky ether. Pokusy najít méně metabolizovatelná anestetika vedly k objevu halogenovaných etherů, například enfluranu a isofluranu. Výskyt jaterních reakcí je u těchto látek nižší. O přesné úrovni hepatotoxicity enfluranu se polemizuje, byť je jen minimálně metabolizován. Isofluran není prakticky vůbec metabolizován a zprávy o poškození jater v souvislosti s touto látkou jsou velmi vzácné.
Historie
Tento halogenovaný uhlovodík byl poprvé syntetizován C. W. Sucklingem z Imperial Chemical Industries (ICI) v roce 1951 a poprvé klinicky použit M. Johnstonem v Manchesteru v roce 1956. Halotan se stal populární jako nehořlavé celkové anestetikum nahrazující jiná inhalační anestetika, například diethylether a cyklopropan. Jeho používání jakožto anestetika bylo ukončeno během 80. a 90. let 20. století s rozmachem novějších anestetik. Stále se však používá ve veterinární chirurgii a v rozvojových zemích díky své nízké ceně.
Halotan byl od svého uvedení v roce 1956 do 80. let podán mnoha milionům dospělých a dětských pacientů po celém světě. Mezi jeho vlastnosti patří při vysokých hladinách kardiální útlum, senzibilizace srdce na katecholaminy (např. norepinefrin) a silná bronchiální relaxace. Nedráždí dýchací cesty a stal se proto vhodnou látkou pro pediatrickou anestezii. Vzhledem ke způsobovanému srdečnímu útlumu byl kontraindikován u pacientů se selháním srdce, se srdeční arytmií, a dále také při stavech vysokých hladin katecholaminů, například při feochromocytomu.
Opakovaná expozice halotanu u dospělých byla ve vzácných případech zmiňována jako příčina vážného poškození jater. Stalo se to v 1 případě z 10 000 expozic. Výsledný syndrom byl označen jako halotanová hepatitida a je patrně výsledkem metabolismu halotanu na kyselinu trifluoroctovou prostřednictvím oxidačních reakcí v játrech. Zhruba 20 % vdechovaného halotanu je metabolizováno v játrech a produkty se vylučují močí. Hepatitický syndrom má úmrtnost 30 až 70 %. Obavy z této hepatitidy vedly k dramatické redukci používání halotanu u dospělých. V 80. letech 20. století byl nahrazen enfluranem a isofluranem. V roce 2005 byly typickými prchavými anestetiky isofluran, sevofluran a desfluran. Protože riziko halotanové hepatitidy je u dětí podstatně nižší než u dospělých, používal se halotan v pediatrii i v 90. letech. Ovšem okolo roku 2000 byl zde z většiny nahrazen sevofluranem.
Fyzikální vlastnosti
| Teplota varu: | 50,2 °C | (101,325 kPa) |
| Hustota: | 1,868 g/cm³ | (20 °C) |
| Molární hmotnost: | 197,4 g/mol | |
| Tlak par: | 244 mmHg | (20 °C) |
| 288 mmHg | (24 °C) | |
| MAC: | 0,75 | % obj. |
| Rozdělovací koeficient krev/plyn: | 2,5 | |
| Rozdělovací koeficient olej/plyn: | 224 |
Syntéza
Komerční syntéza halotanu začíná trichlorethylenem, který reaguje s fluorovodíkem za přítomnosti chloridu antimonitého při 130 °C, přičemž vzniká 2-chlor-1,1,1-trifluorethan. Ten následně reaguje s bromem při 450 °C a vzniká halotan.[2]
Reference
V tomto článku byl použit překlad textu z článku Halothane na anglické Wikipedii.
- ↑ WHO Model List of Essential Medicines [PDF]. World Health Organization, March 2005 [cit. 2006-03-12]. Dostupné v archivu pořízeném dne 2007-02-12.
- ↑ Imperial Chemical Industries. PROCESS FOR THE PREPARATION OF 1,1,1-TRIFLUORO-2-BROMO-2-CHLOROETHANE. Původce vynálezu: Charles Walter SUCKLING. USA, United States Patent Office. Patentový spis 2921098. 1958-06-30. Dostupné: <online> [cit. 2012-06-02]. (anglicky)
Literatura
- Atkinson, Rushman, Lee. A Synopsis of Anaesthesia. 1987.
- Eger, Eisenkraft, Weiskopf. The Pharmacology of Inhaled Anesthetics. 2003.
Externí odkazy
 Obrázky, zvuky či videa k tématu Halotan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Halotan na Wikimedia Commons
Média použitá na této stránce
Structure of 2-bromo-2-chloro-1,1,1-trifluoroethane


