Hapticita

Hapticita je vlastnost ligandů v koordinační chemii udávající počet atomů π-systému ligandu, které se účastní vazby s centrálním atomem.[1][2] Značí se řeckým písmenem η (čte se jako hapto nebo éta[3]), přičemž v horním indexu je uveden počet atomů účastnících se koordinační vazby. Na rozdíl od běžné koordinační vazby, kdy ligand poskytuje volný elektronový pár jednoho ze svých atomů, dochází u těchto ligandů k vazbě přes π-vazbu nebo konjugovaný systém.[4] Hapticitu je nutno rozlišovat od dentacity, která popisuje vícevazebnost ligandu prostřednictvím svých různých izolovaných atomů.
Běžné alkeny, například ethylen nebo propen, jsou typicky η2 ligandy, stejně tak alkeny s nekonjugovanými dvojnými vazbami (s tím rozdílem, že mohou být vícevazné). U konjugovaných π-systémů je situace složitější, jelikož vazbu s centrálním atomem může tvořit celý systém; horním indexem se pak označuje počet atomů tvořících tento konjugovaný systém.[4] Ne vždy se ale vazby s centrálním atomem musí účastnit celý π-systém.[1] Některé ligandy s konjugovaným π-systémem se tak mohou v různých komplexech vázat různými způsoby a vykazovat tak různé hodnoty hapticity. Například allylový aniont se může vázat jako η1 ligand, pokud tvoří vazbu přes svůj terminální uhlík, nebo jako η3, pokud se váže souvisle přes všechny tři uhlíky tvořící konjugovaný systém. Stejně tak se cyklopentadienyl může vázat jako monohapto, trihapto nebo pentahapto ligand.[3][5]
Ligandy vykazující hapticitu
Mezi typické ligandy, které se mohou vázat pomocí svého π-systému, patří ethylen, butadien, benzen nebo cyklopentadienyl.[1]
| Ligand | Struktura ligandu | Hodnota η | Příklad sloučeniny |
|---|---|---|---|
| ethylen | 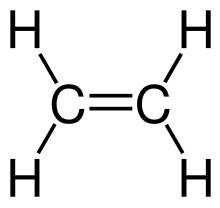 | 2 |  |
| butadien |  | 2 |  |
| 4 |  | ||
| allyl |  | 1 | |
| 3 |  | ||
| cyklopentadienyl |  | 1 | |
| 3 |  | ||
| 5 | |||
| benzen |  | 2 | |
| 4 |  | ||
| 6 |  |
Odkazy
Reference
- ↑ a b c Komplexní sloučeniny – Web o chemii, elektronice a programování. z-moravec.net [online]. [cit. 2024-06-20]. Dostupné online.
- ↑ HOUSECROFT, Catherine; SHARPE, Alan. Anorganická chemie. 1. vyd. Praha: VŠCHT, 2014. 1119 s. ISBN 978-0273-74275-3. S. 834.
- ↑ a b FLEMR, Vratislav; HOLEČKOVÁ, Eva. Úlohy z názvosloví a chemických výpočtů v anorganické chemii [online]. 4. vyd. VŠCHT Praha, 2001 [cit. 2024-06-20]. Dostupné online.
- ↑ a b 2.6: Hapticity. Chemistry LibreTexts [online]. 2019-09-24 [cit. 2024-06-20]. Dostupné online. (anglicky)
- ↑ 13.2: Nomenclature, Ligands, and Classification. Chemistry LibreTexts [online]. 2022-06-15 [cit. 2024-06-20]. Dostupné online. (anglicky)
Média použitá na této stránce
Ball-and-stick model of the tris(butadiene)molybdenum complex, [Mo(bd)3], C12H18Mo.
Structure determination (X-ray diffraction plus computation) from Organometallics (2002) 21, 5021–5028
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.change in hapticity for Ru(benzene)2
Full displayed formula of the benzene molecule, a major industrial chemical, and one of the first known cyclic (ring-shaped) molecules.
The molecular structure of Cramer's dimer, a rhodium ethylene complex. Geberated by Littleinfo using Chemdraw. February, 2007.
It is available for all uses.Chemische Strukturformel
Structure of the cyclopentadienyl anion
Ball-and-stick model of the tris(butadiene)molybdenum complex, [Mo(bd)3], C12H18Mo.
Structure determination (X-ray diffraction plus computation) from Organometallics (2002) 21, 5021–5028
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.general chemical structure of the allyl group
chemical structure of Ni(allyl)2