Heckova reakce
Heckova reakce (také nazývaná Mizorokiova-Heckova reakce[1]) je organická reakce, při níž reaguje nenasycený halogenderivát (nebo triflát) s alkenem za přítomnosti zásady a palladia jako katalyzátoru, přičemž vzniká substituovaný alken. Reakci objevili Richard Frederick Heck a Cutomu Mizoroki; Heck za tento objev v roce 2010 obdržel spolu s Eičim Negišim a Akirou Suzukim Nobelovu cenu za chemii. Tato reakce se stala prvním známým příkladem tvorby vazeb uhlík-uhlík katalyzované palladiem. Heckovou reakcí lze vytvářet substituované alkeny.[2][3][4]

Historie
Roku 1971 popsal Cutomu Mizoroki reakci jodbenzenu se styrenem v methanolu při teplotě 120 °C s použitím octanu draselného jako zásady a chloridu palladnatého jako kazalyzátoru, přičemž navazoval na předchozí studie o reakci arenů s alkeny katalyzované palladnatými sloučeninami[5][6] a o reakcích arylrtuťnatých halogenidů (ArHgCl) s alkeny za přítomnosti stechiometrických množství sloučenin palladia.[7]
 |
| Reakce popsaná Mizorokim v roce 1971 |
|---|
V roce 1972 provedl Heck obdobnou reakci, při které však jako katalyzátor použil octan palladnatý, jako zásadu prostorově stíněný amin a nepoužil rozpouštědlo.[8][9]
 |
| Reakce provedená Heckem v roce 1972 |
|---|
Při těchto reakcích se koordinací palladnaté sloučeniny na alken vytváří elementární palladium, které je aktivním katalyzátorem.
Roku 1974 Heck tuto reakci obměnil tím, že do reakční směsi přidal fosfinové ligandy.[10]
 |
| Reakce provedená Dieckem a Heckem v roce 1974 |
|---|
Katalyzátory a substráty
Katalyzátory Heckovy reakce jsou soli nebo komplexní sloučeniny palladia, jako například tetrakis(trifenylfosfin)palladium(0), chlorid palladnatý a octan palladnatý. Jako pomocné ligandy nejčastěji slouží trifenylfosfin, fosfininooxazoliny a BINAP. Obvykle používanými zásadami jsou triethylamin, uhličitan draselný a octan sodný.
Elektrofilem zde může být bromid, chlorid či triflát, stejně jako benzyl- nebo vinylhalogenid. V molekule alkenu musí být nejméně jedna sp2 vazba C-H.Substituenty snižující elektronovou hustotu, jako například akrylátová skupina, tuto reakci urychlují.[11]
Mechanismus
Při Heckově reakci vznikají jako meziprodukty organické sloučeniny palladia. Sloučeniny palladia v oxidačním čísle 0, které při reakci slouží jako aktivní katalyzátory, se tvoří v reakční směsi z palladnatých prekurzorů.[12][13]
Jako příklad lze uvést octan palladnatý, který se redukuje trifenylfosfinem na bis(trifenylfosfin)palladium(0) (1) a trifenylfosfin se oxiduje na trifenylfosfinoxid. Následuje oxidační adice (A), při které se palladium naaduje na vazbu aryl-bromid; to následně utvoří π komplex s alkenem (3) a poté se alken připojí na palladium (B) syn adicí. Následně nastane rotační přeměna na trans izomer a beta-hydridové eliminaci C, při které vznikne nový π komplex palladia a alkenu (5). Redukční eliminací uhličitanem draselným palladnaté sloučeniny se obnovuje palladium(0) (D).
| Mechanismus Heckovy reakce |
|---|
Stereoselektivita
Heckova reakce je stereoselektivní, jelikož při ní vznikají převážně trans-produkty, protože halogenid palladia a objemný organický zbytek se od sebe při rotačním kroku oddalují. Heckova reakce se průmyslově využívá při výrobě naproxenu a oktylmethoxycinamátu. V průběhu výroby naproxenu dochází k reakci bromovaného naftalenu s ethenem:[14]
 |
| Využití Heckovy reakce při výrobě naproxenu |
|---|
Varianty
Iontová kapalinová Heckova reakce
Za přítomnosti iontové kapaliny k provedení Heckovy reakce není třeba sloučenina fosforu jako ligand; například lze provést reakci, kdy jsou octan palladnatý a iontová kapalina (bmim)PF6 znehybněny v dutinách ailikagelu s obrácenými fázemi.[15] V tomto případě reakce probíhá ve vodě a katalyzátor lze použít znovu.
 |
| Heckova reakce v siloxanu |
|---|
Heckova oxyarylace
Při Heckově oxyarylaci je substituent obsahující palladium nahrazen hydroxylovou skupinou a produkt obsahuje dihydrofuranový cyklus.[16]
 |
| Heckova oxyarylace |
|---|
Aminová Heckova reakce
Aminová Heckova reakce je reakce, při níž vzniká vazba dusík-uhlík. Příkladem je vnitromolekulární reakce oximu, se sunstituenty odtahujícími elektrony, s koncem řetězce dienu, při níž se tvoří derivát pyridinu. Katalyzátorem je tetrakis(trifenylfosfin)palladium(0) a jako zásada slouží triethylamin.
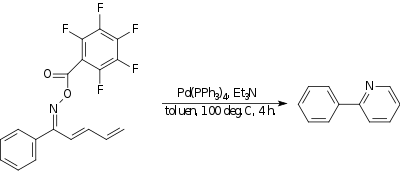 |
| Aminová Heckova reakce |
|---|
Reference
V tomto článku byl použit překlad textu z článku Heck reaction na anglické Wikipedii.
- ↑ Carmen Drahl. In Names, History And Legacy. Chemical & Engineering News. 2010-05-17, s. 31–33. Dostupné online [cit. 2011-06-04].
- ↑ Richard Frederick Heck. Palladium-catalyzed vinylation of organic halides. Organic Reactions. 1982, s. 345–390.
- ↑ A. de Meijere; F. E. Meyer. Fine Feathers Make Fine Birds: The Heck Reaction in Modern Garb. Angewandte Chemie International Edition in English. 1994, s. 2379–2411.
- ↑ Dennis Mc Cartney; Patrick J. Guiry. The asymmetric Heck and related reactions. Chemical Society Reviews. 2011, s. 5122–5150. PMID 21677934.
- ↑ Ichiro Moritani; Yuzo Fujiwara. Aromatic substitution of styrene-palladium chloride complex. Tetrahedron Letters. 1967, s. 1119–1122.
- ↑ Yuzo Fujiwara; Ichiro Moritani; Sadao Danno; Ryuzo Asano; Shiichiro Teranishi. Aromatic substitution of olefins. VI. Arylation of olefins with palladium(II) acetate. Journal of the American Chemical Society. 1969, s. 7166–7169. PMID 27462934.
- ↑ Richard F. Heck. Mechanism of Arylation and Carbomethoxylation of Olefins with Organopalladium Compounds. Journal of the American Chemical Society. 1969, s. 6707–6714.
- ↑ Richard F. Heck; J. P. Nolley. Palladium-catalyzed vinylic hydrogen substitution reactions with aryl, benzyl, and styryl halides. The Journal of Organic Chemistry. 1972, s. 2320–2322.
- ↑ T. Mizoroki; K. Mori; A. Ozaki. Arylation of Olefin with Aryl Iodide Catalyzed by Palladium. Bulletin of the Chemical Society of Japan. 1971, s. 581.
- ↑ H. A. Dieck; R. F. Heck. Organophosphinepalladium complexes as catalysts for vinylic hydrogen substitution reactions. Journal of the American Chemical Society. 1974, s. 1133.
- ↑ LITTKE, A. F.; FU, G. C. Heck reactions of aryl chlorides catalyzed by palladium/tri-tert-butylphosphine: (E)-2-Methyl-3-phenylacrylic acid butyl ester and (E)-4-(2-phenylethenyl)benzonitrile. Org. Synth.. 2005, s. 63. Dostupné online. (anglicky)
- ↑ F. Ozawa; A. Kubo; T. Hayashi. Generation of Tertiary Phosphine-Coordinated Pd(0) Species from Pd(OAc)2 in the Catalytic Heck Reaction. Chemistry Letters. 1992, s. 2177–2180.
- ↑ Michael Bradshaw; Jianli Zou; Lindsay Byrne; K. Swaminathan Iyer; Scott G. Stewart; Colin L. Raston. Pd(II) conjugated chitosan nanofibre mats for application in Heck cross-coupling reactions. Chemical Communications. 2011, s. 12 292 – 12 294. PMID 22011792.
- ↑ Johannes G. De Vries. The Heck reaction in the production of fine chemicals. Canadian Journal of Chemistry. 2001, s. 1086.
- ↑ Isahiro Hagiwara; Yoshitaka Sugawara; Takashi Hoshi; Toshio Suzuki. Sustainable Mizoroki–Heck reaction in water: remarkably high activity of Pd(OAc)2 immobilized on reversed phase silica gel with the aid of an ionic liquid. Chemical Communications. 2005, s. 2942–2944. PMID 15957033.
- ↑ Lorand Kiss; Tibor Kurtan; Sandor Antus; Henri Brunner. Further insight into the mechanism of Heck oxyarylation in the presence of chiral ligands. Arkivoc. 2003, s. GB–653J. Dostupné online. PMID 15957033.
Externí odkazy
 Obrázky, zvuky či videa k tématu Heckova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Heckova reakce na Wikimedia Commons
Média použitá na této stránce
Autor: Polimerek, Licence: CC BY-SA 3.0
modification of w:en:polysiloxanes via w:en:Heck reaction
Autor: Polimerek, Licence: CC BY-SA 3.0
w:en:Heck reaction used for synthesis od w:en:naproxen
Copyright © Axel Müller / Wikimedia Commons, CC BY 3.0 de
Mechanism of the Heck reaction: A oxidative addition, B insertion, C β-hydride elimination, D reductive elimination
Autor: Dissolution, Licence: CC BY-SA 3.0
Mizoroki-Heck 1971 iodobenzene styrene
Autor: Dissolution, Licence: CC BY-SA 3.0
Heck 1972 iodobenzene styrene









