Hexadehydro Dielsova–Alderova reakce
Hexadehydro Dielsova–Alderova reakce (zkráceně HDDA) je organická reakce konjugovaného diynu (uhlovodíku s dvěma trojnými vazbami v molekule) a alkynu za vzniku arynového meziproduktu [4+2] cykloadicí.[1][2][3] Tento meziprodukt pak dále reaguje za tvorby substituovaného arenu. Reakce je obdobou Dielsovy–Alderovy reakce a probíhá podobným mechanismem. Je obzvláště užitečná při syntéze vysoce substituovaných arenů nebo většího počtu cyklů v jednom syntetickém kroku.

Mechanismus
V závislosti na vlastnostech substrátu může být HDDA iniciována tepelně nebo vhodným katalyzátorem.[1][2][4][5] Při tepelné iniciaci převažuje [4+2] cykloadice konjugovaného diynu (1,3-dialkynu) s alkynem (často označovaným pojmem diynofil) způsobem podobným Dielsově–Alderově reakci.[1][2]
Nejjednodušším příkladem je reakce butadiynu s ethynem za vzniku o-benzynu.[6] Ten pak reaguje s další látkou, obsahující nukleofilní (Nu-) a elektrofilní (El-) skupinu za vzniku konečného produktu.
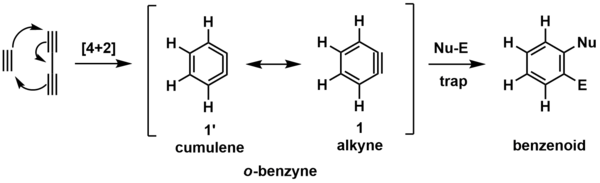
Meziprodukt se vyskytuje ve dvou rezonančních strukturách. Nejčastěji se zobrazuje v cykloalkynové podobě (1), ovšem pro pochopení tvorby cyklu může být vhodnější zobrazení kumulenové formy (2).
Termodynamika a kinetika
Hexadehydro Dielsova–Alderova reakce je většinou exotermická, může však mít vysokou aktivační energii. Podle numerických výpočtů je aktivační energie vzniku nesubstituovaného o-benzynu 151 kJ/mol, reakce je ovšem se změnou entalpie -213 kJ/mol exotermická.[6] Kvůli vyšším aktivačním energiím se některé HDDA musí provádět za vyšších teplot (nad 100 °C).
Druhý krok je také exotermní, u reakce o-benzynu substituovaného esterovou skupinou s terc-butanolem je změna entalpie -351 kJ/mol.[1]

HDDA může probíhat soustředěným nebo diradikálovým mechanismem. Tyto mechanismy mají rozdílné aktivační energie. Metodami výpočetní chemie bylo zjištěno, že u nesubstituovaných dienofilů jsou aktivační energie podobné, zatímco u substituovaných diynofilů má diradikálový mechanismus nižší aktivační energii a proto reakce probíhá převážně tímto způsobem..[6][7]
Regiochemie
Regiochemie produktu hexadehydro Dielsovy–Alderovy reakce lze odvodit kombinací elektronových efektů a vlivu a jevů způsobujících změnu tvaru cyklu.[1] Na níže uvedeném obrázku odpovídá poloha a benzynovému uhlíku s menší elektronovou hustotou (δ+) a b uhlíku s větší elektronovou hustotou (δ-).

Názvosloví
Hexadehydro Dielsova–Alderova reakce je obdobou klasické Dielsovy–Alderovy reakce. Lze ji také považovat za součást řady pericyklických reakcí s rostoucí úrovní nenasycenosti).[1] Označení „hexadehydro“ je odvozeno od skutečnosti, že nejjednodušší produkt této reakce, o-benzyn, má v molekule 4 atomy vodíku, tedy o 6 méně než nejjednodušší produkt Dielsovy–Alderovy reakce, kterým je cyklohexen s 10 vodíky.

Historie
První hexadehydro Dielsovy–Alderovy reakce byly popsány v roce 1997.[2][8][9][9][10] První z těchto reakcí byla cyklizace nona-1,3,8-triynu vakuovou termolýzou (600 °C, 10−2 torr) za vzniku dvou produktů, indanu a indenu (jenž je výsledkem dehydrogenace), s 95% celkovou výtěžností. Pomocí značkování deuteriem bylo zjištěno, že produkt vzniká [4,2] cyklizací za vzniku benzynového meziproduktu, ze kterého se vytvářejí pozorované produkty.[8] Bylo zjištěno, že acyklické tetrayny se cyklizují za pokojové teploty, přičemž se tvoří deriváty 5H-fluorenolu. Tvorba benzynu byla potvrzena studiemi, při kterých byl použit benzen nrbo antracen k zachycení benzynu.[10] Benzyn se podařilo zachytit také řadou dalších nukleofilů (kyslíkatých, dusíkatých i sirných). Také se ukázalo, že lze pomocí HDDA připravovat polycyklické látky.[11][12][13][14][15]
HDDA nebyla příliš používána až do roku 2012, kdy tým vedený T. R. Hoyem prozkoumal možnosti této reakce.[1] V příslušné studii byla reakce označena jako „hexadehydro Dielsova–Alderova“ (HDDA) a toto označení se začalo častěji používat.[16]
Srovnání s jinými metodami
Jednou z hlavních výhod HDDA reakce oproti ostatním způsobům přípravy benzynů je jednoduchost provedení, HDDA cyklizace triynů a tetraynů vede ke vzniku benzynů bez přímé tvorby vedlejších produktů. Při přípravě benzynů odstraněním ortho-substituentů se tvoří stechiometrická množství vedlejších produktů, například příprava benzynu z jednoho molu 2-trimethylsilylfenyltrifluormethansulfonátu vede ke vzniku jednoho molu trimethylsilylfluoridu a jednoho molu triflátových aniontů. Vedlejší produkty mohou znesnadňovat zachytávání benzynu, způsobovat vedlejší reakce a ztěžovat přečištění hlavních produktů.
HDDA také lze použít v případech, kdy dané reaktanty nejsou vhodné pro ostatní metody přípravy benzynů (například ty, při kterých se používají silné zásady). Tepelně iniciované HDDA reakce mohou být prováděny za přítomnosti esterů, ketonů, etherů, arylhalogenidů, alkylhalogenidů, alkenů, cyklopropanů a chráněných aminů a amidů.[1][4][17]
Využití
Vnitromolekulární syntéza polycyklických sloučenin
HDDA lze použít k získání polycyklických sloučenin z acyklických prekurzorů, kterými jsou diyn, diynofil a zachytávající skupiny. Příkladem se příprava tricyklických produktů z triynů tepelně iniciovanou vnitromolekulární HDDA reakcí.[1] Při této reakci lze pomocí vhodných prekurzorů vytvořit kyslíkaté i dusíkaté heterocykly. V takovém případě se jako zachytávající skupina používá silylenolether a součástí procesu je retro-Brookův přesmyk.
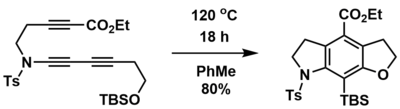
Mezimolekulární syntéza polycyklických sloučenin
Benzyny vzniklé při hexadehydro Dielsově–Alderově reakci se mohou za přítomnosti vhodného reaktantu účastnit mnoha mezimolekulárních reakcí. Tímto reaktantem (pokud jde například o arylhalogenid nebo derivát fenolu či anilinu) je možné do produktu zabudovat další skupiny.[1][18]

Enové reakce
HDDA reakce mohou být součástí reakční posloupnosti společně s enovými reakcemi, jako jsou Alderova enová reakce a aromatická enová reakce.[16][19] Benzyny vytvořené pomocí HDDA lze zachytit vhodným enovým donorem. Benzyn zde funguje jako enofil a jako en lze použít alken (Alderův en) nebo aren (aromatický en). Kaskádovými reakcemi zahrnujícími hexadehydro Dielsovy–Alderovy reakce lze připravit mnoho produktů, například středně velké kondenzované cykly, spirosloučeniny a alleny.[16]

T. R. Hoye popsal tepelně iniciovanou sérii HDDA, aromatické a Alderovy enové reakce vedoucí v jediném kroku ke vzniku vysoce funkcionalizovaných produktů bez tvorby vedlejších produktů.[19]

Dehydrogenace
Benzyny získané pomocí HDDA lze rovněž použít k dehydrogenaci alkanů za tvorby alkenů.[20] Benzyn může odstranit sousední atomy vodíku z vhodného donoru, kterým je často rozpouštědlo (například tetrahydrofuran nebo cyklooktan), což vede ke vzniku nenasyceného produktu, a z benzynu se stává dihydrobenzenoid. Pomocí izotopového značkování a výpočetních metod bylo zjištěno, že odštěpení vodíku probíhá soustředěným mechanismem a rychlost reakce je silně závislá na konformaci alkanu.[20] Takovouto reakci je možné použít na přípravu 1,2,3,4-tetrasubstituovaných arenů, které se jinými metodami připravují jen obtížně.

Aktivace vazby C-H
Hexadehydro Dielsova–Alderova reakce je součástí některých metod Aktivace vazby uhlík-vodík, kdy alkan reaguje s komplexem kovu a arynového meziproduktu. Katalyzátory obsahující přechodné kovy vyvolávají HDDA reakce tetraynů zachycovaných sp3 C-H vazbami.[4] Těchto reakcí se mohou účastnit primární, sekundární i terciární vazby C-H, přičemž nejúčinnějšími katalyzátory jsou stříbrné soli. Pomocí deuteriového značkování bylo zjištěno, že zánik vazby sp3 a následný vznik vazby sp2 probíhá soustředěným mechanismem.

Fluorace
Stříbrem katalyzované HDDA reakce lze také použít k přípravě organofluoridů pomocí iontu obsahujícího fluor.[17] Vznikající komplexy aryn-kov lze zachytit protiiontem a získat tak areny s fluorovými, trifluormethylovými nebo trifluormethylthiolovými substituenty.

Dominové hexadehydro Dielsovy–Alderovy reakce
Některé polyyny mohou při zahřátí reagovat v kaskádových [4+2] cykloadicích.[21] Tyto reakce bývají iniciovány tvorbou benzynu, která je nejpomalejším krokem reakce. Lze využít naftynové, antracynové i tetracynové meziprodukty.

Aza HDDA reakce
Do hexadehydro Dielsových–Alderových reakcí se mohou zapojit i nitrily, v takových případech vznikají pyridinové meziprodukty.[22] Tímto způsobem je možné připravovat i vysoce funkcionalizované deriváty pyridinu.

Reference
V tomto článku byl použit překlad textu z článku Hexadehydro Diels–Alder reaction na anglické Wikipedii.
- ↑ a b c d e f g h i j Hoye, T. R.; Baire, B.; Niu, D.; Willoughby, P. H.; Woods, B. P. Nature, 2012, 490, 208 [1]
- ↑ a b c d Holden, C.; Greaney, M. F. Angewandte Chemie International Edition in English, 2014, 53, 5746 [2]
- ↑ Yeoman, J. T. S.; Reisman, S. E. Nature, 2012, 490, 179
- ↑ a b c Yun, S. Y.; Wang, K.-P.; Lee, N.-K.; Mamidipalli, P.; Lee, D. J. Am. Chem. Soc., 2013, 135, 4668 [3]
- ↑ Vandavasi, J. K.; Hu, W.-P.; Hsiao, C.-T.; Senadi, G. C.; Wang, J.-J. RSC Adv., 2014, 4, 57547 [4]
- ↑ a b c Ajaz, A.; Bradley, A. Z.; Burrell, R. C.; Li, W. H. H.; Daoust, K. J.; Bovee, L. B.; DiRico, K. J.; Johnson, R. P. J. Org. Chem., 2011, 76, 9320 [5]
- ↑ Liang, Y.; Hong, X.; Yu, P.; Houk, K. N. Org. Lett., 2014, 16, 5702 [6]
- ↑ a b Bradley, A. Z.; Johnson, R. P. J. Am. Chem. Soc., 1997, 119, 9917 [7]
- ↑ a b Cahill, K. J.; Ajaz, A.; Johnson, R. P. Aust. J. Chem., 2010, 63, 1007 [8]
- ↑ a b Miyawaki, K.; Suzuki, R.; Kawano, T.; Ueda, I. Tetrahedron Lett., 1997, 38, 3943 [9]
- ↑ Ueda, I.; Sakurai, Y.; Kawano, T.; Wada, Y.; Futai, M. Tetrahedron Lett., 1999, 40, 319 [10]
- ↑ Miyawaki, K.; Kawano, T.; Ueda, I. Tetrahedron Letters, 2000, 41, 1447 [11]
- ↑ K. Miyawaki, F. Ueno, I. Ueda, Heterocycles, 2001, 54, 887 [12]
- ↑ Torikai, K.; Otsuka, Y.; Nishimura, M.; Sumida, M.; Kawai, T.; Sekiguchi, K.; Ueda, I. Bioorg. Med. Chem., 2008, 16, 5441 [13]
- ↑ Kimura, H.; Torikai, K.; Miyawaki, K.; Ueda, I. Chem. Lett., 2008, 37, 662 [14][nedostupný zdroj]
- ↑ a b c Karmakar, R.; Mamidipalli, P.; Yun, S. Y.; Lee, D. Organic Letters, 2013, 15, 1938 [15]
- ↑ a b Wang, K.-P.; Yun, S. Y.; Mamidipalli, P.; Lee, D. Chem. Sci., 2013, 4, 3205 [16]
- ↑ Niu, D.; Wang, T.; Woods, B. P.; Hoye, T. R. Organic Letters, 2014, 16, 254 [17]
- ↑ a b Niu, D.; Hoye, T. R. Nat. Chem., 2014, 6, 34
- ↑ a b Niu, D.; Willoughby, P. H.; Woods, B. P.; Baire, B.; Hoye, T. R. Nature, 2013, 501, 531 [18]
- ↑ Xiao Xiao; Thomas R. Hoye. The domino hexadehydro-Diels–Alder reaction transforms polyynes to benzynes to naphthynes to anthracynes to tetracynes (and beyond?). Nature Chemistry. 2018-07-20, s. 838–844. ISSN 1755-4349. PMID 30030536. Bibcode 2018NatCh..10..838X.
- ↑ Severin K. Thompson; Thomas R. Hoye. The Aza-hexadehydro-Diels–Alder Reaction. Journal of the American Chemical Society. 2019-12-01, s. 19575–19580. ISSN 0002-7863. PMID 31789026.
Externí odkazy
 Obrázky, zvuky či videa k tématu Hexadehydro Dielsova–Alderova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hexadehydro Dielsova–Alderova reakce na Wikimedia Commons
Média použitá na této stránce
Structure of HDDA Thermodynamics}
Structure of HDDA Distorted Bond Angles
Structure of HDDA-dericved Heterocycle
Structure of DA/DHDA/THDA/HDDA Comparison
Structure of HDDA-Aromatic-Ene-Alder-Ene Reaction
Structure of HDDA Alder-Ene Reaction
Structure of HDDA Dehydrogenation
Structure of Generalized HDDA Reaction
Structure of HDDA C-H Activation
Structure of HDDA Fluorination
Structure of HDDA Intermolecular Trapping
Autor: Xmenxzero, Licence: CC BY-SA 4.0
a tetracyne can be generated from a nonayne via domino HDDA
Structure of Butadiyne-Acetylene HDDA Reaction