Hexafluoraceton
| Hexafluoraceton | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | hexafluorpropan-2-on, 1,1,1,3,3,3-hexafluorpropan-2-on |
| Ostatní názvy | perfluoraceton, perfluorpropanon, HFA |
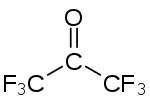
| Funkční vzorec | CF3C(O)CF3 |
| Sumární vzorec | C3F6O |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 684-16-2 |
| EC-no (EINECS/ELINCS/NLP) | 211-676-3 |
| PubChem | 12695 |
| ChEBI | 39429 |
| SMILES | FC(F)(F)C(=O)C(F)(F)F |
| InChI | 1/C3F6O/c4-2(5,6)1(10)3(7,8)9 |
| Vlastnosti | |
| Molární hmotnost | 166,02 g/mol |
| Teplota tání | −129 °C (144 K) |
| Teplota varu | −28 °C (245 K) |
| Hustota | 1,32 g/cm3 |
| Rozpustnost ve vodě | reaguje |
| Tlak páry | 590 kPa (20 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H280 H301 H310 H311 H314 H315 H318 H330 H360 H370 H372 |
| P-věty | P201, P202, P260, P262, P264, P270, P271, P280, P281, P284, P301+330+331, P301+310 P302+350, P302+352, P303+361+353, P304+340, P305+351+338, P307+311, P308+313, P310, P312, P314, P320, P321, P322 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Hexafluoraceton (zkráceně HFA) je organická sloučenina se vzorcem (CF3)2CO, patřící mezi fluorované ketony. Je odvozena od acetonu nahrazením všech šesti vodíkových atomů atomy fluoru. Jedná se o bezbarvý hygroskopický nehořlavý a velmi reaktivní plyn s plesnivým zápachem.[2]
Nejčastěji se nachází ve formě seskvihydrátu (·1,5 H2O), který je sám hemihydrátem hexafluoropropan-2,2-diolu, patřícího mezi geminální dioly.
Výroba a příprava
Průmyslově se hexafluoraceton vyrábí reakcí hexachloracetonu s kyselinou fluorovodíkovou:[3]
- (CCl3)2CO + 6 HF → (CF3)2CO + 6 HCl
V laboratoři jej lze získat dvoustupňovou syntézou z hexafluorpropenu, který v prvním kroku reaguje za přítomnosti fluoridu draselného s elementární sírou za vzbiku 1,3-dithietanu [(CF3)2CS]2. Tato látka se následně oxiduje jodičnanem na hexafluoraceton.[4]
Použití
Hexafluoraceton se používá na výrobu hexafluor-propan-2-olu následující reakcí:
- (CF3)2CO + H2 → (CF3)2CHOH
Také slouží jako prekurzor dalších sloučenin, kterými jsou:
- hexafluorisobuten, (CF3)2C=CH2, monomer.[3]
- midaflur
- bisfenol AF
- 4,4′-(hexafluorisopropyliden)diftalanhydrid
Reaktivita
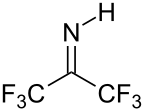
Hexafluoraceton je elektrofilní látka, nukleofily s ním reagují na karbonylovém uhlíku. Ve vodě se vyskytuje převážně ve formě hydrátu. Rovnovážná konstanta tvorby geminálního diolu je přibližně 106, zatímco u acetonu má hodnotu asi 10−3.[5] Hydráty hexafluoracetonu jsou kyselé povahy. Adicí amoniaku na hexafluoraceton vzniká poloaminal (CF3)2C(OH)(NH2), který lze dehydratovat fosforylchloridem za vzniku iminu (CF3)2C=NH.[6]
Odkazy
Související články
- Bromaceton
- Chloraceton
- Fluoraceton
- Trifluoraceton
- Novec 1230
- Hexafluorthioaceton
Externí odkazy
 Obrázky, zvuky či videa k tématu Hexafluoraceton na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hexafluoraceton na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Hexafluoroacetone na anglické Wikipedii.
- ↑ a b Hexafluoroacetone. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ CDC - NIOSH Pocket Guide to Chemical Hazards
- ↑ a b Günter Siegemund; Werner Schwertfeger; Andrew Feiring; Bruce Smart; Fred Behr; Herward Vogel; Blaine McKusick. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2002. DOI 10.1002/14356007.a11_349. Kapitola Fluorine Compounds, Organic.
- ↑ M. VAN DER PUY, L. G. ANELLO. Hexafluoroacetone. Org. Synth.. 1990. Dostupné online. (anglicky); Coll. Vol.. S. 251. (anglicky)
- ↑ David M. Lemal. Perspective on Fluorocarbon Chemistry. The Journal of Organic Chemistry. 2004, s. 1–11. PMID 14703372.
- ↑ W. J. Middleton; H. D. Carlson. Hexafluoroacetone imine. Organic Syntheses. 1970, s. 81–83.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
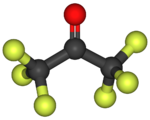
Ball-and-stick model of hexafluoroacetone (hexafluoropropanone). Created using Accelrys DS Visualizer Pro 1.7 and GIMP.
Autor: Hbf878, Licence: CC0
Strucure of hexafluoracetone imine, a ketimine.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gases under pressure