Hexan-2,5-dion
| Hexan-2,5-dion | |
|---|---|
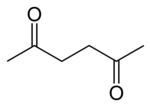 strukturní vzorec | |
| Obecné | |
| Systematický název | Hexan-2,5-dion |
| Ostatní názvy | acetonylaceton, 1,2-diacetylethan, diacetonyl, 2,5-dioxohexan, 2,5-diketohexan |
| Anglický název | hexane-2,5-dione |
| Německý název | 2,5-Hexandion |
| Funkční vzorec | H3CCO(CH2)2COCH3 |
| Sumární vzorec | C6H10O2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 110-13-4 |
| PubChem | 8035 |
| SMILES | O=C(C)CCC(=O)C |
| InChI | 1S/C6H10O2/c1-5(7)3-4-6(2)8/h3-4H2,1-2H3 |
| Číslo RTECS | MO3150000 |
| Vlastnosti | |
| Molární hmotnost | 114,143 8 g/mol |
| Teplota tání | −5,5 °C (267,6 K) |
| Teplota varu | 191,4 °C (564,6 K) |
| Hustota | 0,973 g/cm3 |
| Rozpustnost ve vodě | ≥10 g/100 ml (22 °C) |
| Měrná magnetická susceptibilita | −5,48×105 μm3/g |
| Bezpečnost | |
| [1] Varování[1] | |
| Teplota vzplanutí | 78 °C |
Některá data mohou pocházet z datové položky. | |
Hexan-2,5-dion je alifatický diketon a toxický metabolit hexanu a hexan-2-onu u člověka.
Příznaky otravy
Chronická toxicita hexanu je způsobena jeho metabolizováním na hexan-2,5-dion. Příznaky otravy jsou brnění a křeče v rukách a nohách, následované celkovou svalovou slabostí. V některých případech byla pozorována atrofie kosterních svalů spolu se ztrátou koordinace a zrakovými problémy.[2]
Podobné příznaky byly pozorovány u zvířat. Jsou spojené s degenerací periferních nervů (a také centrálního nervstva).
Mechanismus účinku
Předpokládá se, že neurotoxicita hexan-2,5-dionu vyplývá z jeho γ-diketonové struktury, neboť hexan-2,3-dion, hexan-2,4-dion a heptan-2,6-dion nejsou neurotoxické, ovšem heptan-2,5-dion, oktan-3,6-dion a ostatní γ-diketony jsou.[3] Vyšší α-diketony, jako pentan-2,3-dion a hexan-2,3-dion, se dokonce v malých množstvích nacházejí v různých potravinách a používají se jako atromatické přísady do nealkoholických nápojů a pečiva.[4]
Hexan-2,5-dion reaguje s pozůstatky lysinu v axonových bílkovinách za tvorby Schiffových bází následovanou cyklizací za vzniku pyrrolů. Oxidace pyrrolů má za následek síťování mezi dvěma n-hexanem modifikovanými proteiny. Výsledná denaturace proteinů naruší axonální transport a způsobí poškození nervových buněk.[5]
Výroba
Byl popsán proces výroby hexan-2,5-dionu.[6]
Použití
Acetonylaceton může být použit v syntéze isokarboxazidu, rolgamidinu a mopidralazinu.
Odkazy
Externí odkazy
 Obrázky, zvuky či videa k tématu Hexan-2,5-dion na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hexan-2,5-dion na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Hexane-2,5-dione na anglické Wikipedii.
- ↑ a b 2,5-Hexanedione. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Couri D, Milks M. "Toxicity and metabolism of the neurotoxic hexacarbons n-hexane, 2-hexanone, and 2,5-hexanedione" Annu. Rev. Pharmacol. Toxicol. 1982;22:145-66.
- ↑ Stephen R. Clough; LEYNA MULHOLLAND. Encyclopedia of Toxicology. 2nd. vyd. [s.l.]: Elsevier, 2005. Kapitola Hexane, s. 522–525. (anglicky)
- ↑ Hardo Siegel; MANFRED EGGERSDORFER. Ullmann's Encyclopedia of Industrial Chemistry. 7th. vyd. [s.l.]: Wiley, 2007. Kapitola Ketones, s. 16. (anglicky)
- ↑ Wolfgang Dekant; SPIRIDON VAMVAKAS. Ullmann's Encyclopedia of Industrial Chemistry. 7th. vyd. [s.l.]: Wiley, 2007. Kapitola Toxicology, s. 23. (anglicky)
- ↑ http://www.prepchem.com/synthesis-of-2-5-hexanedione/ Primary: Systematic organic chemistry, by W. M. Cumming, 194, 1937.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.




