Histidin
| Histidin | |
|---|---|
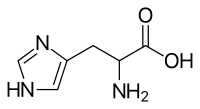 strukturní vzorec | |
 model molekuly | |
| Obecné | |
| Systematický název | 2-amino-3-(1H-imidazol-4-yl)propanová kyselina |
| Triviální název | Histidin |
| Ostatní názvy | glyoxalin-5-alanin |
| Anglický název | Histidine |
| Sumární vzorec | C6H9N3O2 |
| Vzhled | bílé krystaly |
| Identifikace | |
| Registrační číslo CAS | 71-00-1 |
| PubChem | 773 |
| SMILES | c1c(nc[nH]1)C[C@@H](C(=O)O)N |
| InChI | InChI=1S/C6H9N3O2/c7-5(6(10)11)1-4-2-8-3-9-4/h2-3,5H,1,7H2,(H,8,9)(H,10,11)/t5-/m0/s1 |
| Vlastnosti | |
| Molární hmotnost | 155,16 g/mol |
| Teplota tání | 282–287 °C |
| Disociační konstanta pKa | 1,78 |
| Disociační konstanta pKb | 5,97 |
| Bezpečnost | |
| [1] Varování[1] | |
Některá data mohou pocházet z datové položky. | |
Histidin (zkratky His nebo H) je jedna z nejběžnějších přírodních aminokyselin přítomných v proteinech. Ve smyslu výživy je u člověka histidin považován za esenciální aminokyselinu. Původně se myslelo, že je esenciální jen u dětí (semiesenciální), ale dlouhodobé studie ukazují, že je nezbytný i pro dospělé.[2] Jeho kodóny jsou CAU a CAC.
Histidin byl poprvé izolován německým lékařem Albrechtem Kosselem v roce 1896.[3]
Funkce a vlastnosti
Chemické vlastnosti
Histidin se řadí mezi bazické aminokyseliny, vzhledem k disociační konstantě (pKa) své imidazolové postranní skupiny ležící v neutrálním pH je ale jeho náboj ve fyziologických podmínkách velmi citlivý na změny pH: teoreticky je pKa histidinu 6, v nižším (kyselejším) pH je tedy histidin protonovaný a nese kladný náboj, při vyšším pH není nabitý. Jeho skutečná pKa se v proteinech ovšem může pohybovat mezi pH 4–10 v závislosti na okolním prostředí.[4] Díky této vlastnosti umožňuje proteinům citlivě reagovat na změny pH, například Bohrův efekt (schopnost hemoglobinu uvolnit kyslík v kyselejším – odkysličeném – prostředí) je závislý právě na této vlastnosti histidinu.[5]
Imidazolová postranní skupina má aromatický charakter,[6] kladný náboj získávaný v kyselém pH ale možné patrové interakce komplikuje.
Význam v proteinech
V proteinech se histidin často vyskytuje v aktivních centrech enzymů, místech kontaktů mezi proteiny a slouží k vazbě kovů (zinek, železo). Vzhledem k jednoduchosti, se kterou může být histidin protonovaný a deprotonovaný, slouží často jako prostředník v přenosu náboje, například v katalytických triádách tvořících centra hydroláz a transferáz, nejčastěji cysteinových a serinových proteáz.[7] Dalším příkladem může být role v enzymu karbonické anhydráze, ve které jsou v aktivním místě čtyři histidiny – tři drží atom zinku, který z vody odtrhne skupinu -OH, a čtvrtý naváže zbylý vodík. Na -OH skupinu se následně naváže oxid uhličitý a vzniká rozpustný hydrogenuhličitan, v jehož podobě je oxid uhličitý přepravován krví.
Další využití
V lidském těle funguje histidin jako prekurzor pro výrobu histaminu a karnosinu. Histamin je signální molekula spouštějící zánětlivou reakci a slouží jako neurotransmiter, z histidinu vzniká dekarboxylací. Při vazbě beta-alaninu na histidin se vytváří karnosin, jehož disociační konstanta je posunutá ještě blíže k fyziologickému pH (pKa = 6,83), čímž slouží jako výborný pufr, který je využíván především ve svalech.
V molekulární biologii se využívá tzv. polyhistidinový tag, což je sekvence šesti histidinů připojených ke studovanému proteinu metodami genového inženýrství, která slouží pro detekci a afinitní purifikaci zkoumaného proteinu.
Posttranslační modifikace

Histidin je jednou z aminokyselin, které mohou být posttranslačně modifikovány fosforylací. Toho využívá bakteriální dvoukomponentový regulační systém složený z histidinové kinázy, která je nejčastěji vázaná na membránu a po přijetí stimulu fosforyluje sebe sama na histidinech. Vzniká N-fosfo-L-histidin, který není příliš stabilní a fosfát je z něj přesunut na druhou komponentu systému, která je tímto aktivována. Dvoukomponentový regulační systém se vyskytuje u eukaryot jen vzácně a enzymy příbuzné histidinovým kinázám v lidských mitochondriích nemají aktivitu histidinových kináz. Navzdory tomu jsou některé proteiny u lidí na histidinech fosforylovány, i když mechanismus ani význam těchto modifikací není dobře prozkoumaný.[8]
V eukaryotickém elongačním faktoru 2 je histidin modifikován do podoby diftamidu. Tato modifikace je složitá, vyžaduje čtyři enzymatické kroky a je známá pouze z tohoto proteinu. Její funkce je nejasná, ale je nezbytná pro proteosyntézu a modifikace dipthamidu (například diphtheria toxinem při záškrtu) vede ke smrti buněk.[9]
Zdroje
Histidin je esenciální aminokyselina, člověk ji tedy musí přijímat v potravě.
Metabolismus
Degradace
Histidin je u lidí degradován v pěti krocích, po kterých vznikne alfa-ketoglutarát, který vstupuje do cyklu kyseliny citrónové. V prvním kroku enzym histidinlyáza přeměňuje histidin na amoniak a kyselinu urokanovou. Nedostatek tohoto enzymu se projevuje ve vzácné metabolické poruše histidinemii. Histidin má oproti alfa-ketoglutarátu jeden uhlík navíc, k odpojení uhlíku ve čtvrtém kroku je využíván kofaktor tetrahydrofolát.[10]
Odkazy
Reference
- ↑ a b Histidine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ KOPPLE, JD.; SWENDSEID, ME. Evidence that histidine is an essential amino acid in normal and chronically uremic man.. J Clin Invest. May 1975, roč. 55, čís. 5, s. 881–91. Dostupné online. doi:10.1172/JCI108016. PMID 1123426.
- ↑ JONES, M. E. Albrecht Kossel, a biographical sketch. Yale J Biol Med.. 1953, roč. 26, čís. 1, s. 80–97. Dostupné online. ISSN 0044-0086.
- ↑ WHITFORD, David. Proteins: Structure and Function. 1.. vyd. [s.l.]: Wiley, 2005. 542 s. Dostupné online. ISBN 978-0471498940. Kapitola 2. Amino acids: the building blocks of proteins, s. 44–45. (anglicky)
- ↑ ZHENG, G.; SCHAEFER, M.; KARPLUS, M. Hemoglobin Bohr effects: atomic origin of the histidine residue contributions.. Biochemistry. Nov 2013, roč. 52, čís. 47, s. 8539–55. doi:10.1021/bi401126z. PMID 24224786.
- ↑ WANG, L.; SUN, N.; TERZYAN, S., et al. A histidine/tryptophan pi-stacking interaction stabilizes the heme-independent folding core of microsomal apocytochrome b5 relative to that of mitochondrial apocytochrome b5.. Biochemistry. Nov 2006, roč. 45, čís. 46, s. 13 750 – 13 759. doi:10.1021/bi0615689. PMID 17105194.
- ↑ BARNES, Michael R. Bioinformatics for Geneticists: A Bioinformatics Primer for the Analysis of Genetic Data. [s.l.]: Wiley, 2007. 576 s. ISBN 978-0470026205. Kapitola 14: Amino Acid Properties and Consequences of Substitutions, s. en. (anglicky)
- ↑ ATTWOOD, PV. Histidine kinases from bacteria to humans.. Biochem Soc Trans. Aug 2013, roč. 41, čís. 4, s. 1023–8. doi:10.1042/BST20130019. PMID 23863173.
- ↑ SCHAFFRATH, R.; ABDEL-FATTAH, W.; KLASSEN, R., et al. The diphthamide modification pathway from Saccharomyces cerevisiae - revisited.. Mol Microbiol. Dec 2014, roč. 94, čís. 6, s. 1213–26. doi:10.1111/mmi.12845. PMID 25352115.
- ↑ NELSON, David L.; COX, Michael M. Lehninger Principles of Biochemistry. [s.l.]: W.H. Freeman, 2013. Dostupné online. ISBN 978-1429234146. Kapitola 18: Amino Acid Oxidation and the Production of Urea. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Histidin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Histidin na Wikimedia Commons - Biosyntéza histidinu (Raná fáze)
- Biosyntéza histidinu (Pozdní fáze)
- Katabolismus histidinu
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
chemical structure of diphthamide created with ChemDraw
L--histidine-acid-3D-sticks
Structure of histidine




