Homogenní katalýza
Homogenní katalýza je označení skupiny katalytických reakcí, při kterých jsou katalyzátory přítomny ve stejné fázi jako reaktanty, obvykle jde o roztoky. Opakem je heterogenní katalýza, kdy je katalyzátor v jiné fázi než reaktanty, nejčastěji je katalyzátor pevný a reaktanty jsou plynné.[1]
Většina těchto reakcí bývá katalyzována organokovovými sloučeninami.
Příkladem využití může být výroba kyseliny octové; k homogenním katalyzátorům patří mimo jiné enzymy.[2]
Příklady

Kyselá katalýza
Protony lze použít jako homogenní katalyzátory,[4] protože voda, používaná jako nejběžnější rozpouštědlo, uvolňuje autoionizací. Kyseliny mohou například urychlovat hydrolýzu esterů:
- CH3CO2CH3 + H2O ⇌ CH3CO2H + CH3OH
Při neutrálním pH hydrolýza většiny esterů ve vodných roztocích probíhá nevyužitelně pomalu.
Katalýza pomocí přechodných kovů
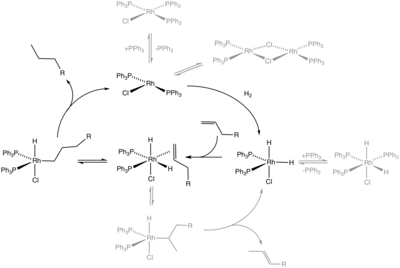
Hydrogenace a podobné reakce
Významnou skupinou redoxních reakcí jsou hydrogenace. Při nich se aduje H2 na nenasycené substráty. Zvláštní případ představuje přenosová hydrogenace, kdy se vodík přesouvá z jednoho substrátu (donoru vodíku) na jiný (akceptor vodíku). Podobnými reakcemi jsou adice HX, kde X = silyl (pak jde o hydrosilylaci) nebo CN (v tomto případě se jedná o hydrokyanaci). Většina průmyslových hydrogenací – při výrobě margarinů, amoniaku a hydrogenaci benzenu na cyklohexan – se katalyzuje heterogenně. Některé chemické syntézy ovšem vyžadují homogenní katalyzátory.
Karbonylace
Hydroformylace, významný druh karbonylace, spočívá v adici H a C(O)H na dvojnou vazbu; přitom se téměř vždy používají rozpustné katalyzátory založené na komplexech rhodia a kobaltu.[5]
Podobnou karbonylací je přeměna alkoholů na karboxylové kyseliny. Methanol a oxid uhelnatý reagují za přítomnosti homogenního katalyzátoru za vzniku kyseliny octové, což se využívá v procesech Monsanto a Cativa. Podobnými reakcemi jsou hydrokarboxylace a hydroesterifikace.
Polymerizace a metateze alkenů
Mnoho polyalkenů, například polyethylen a polypropylen, se vyrábí za katalýzy Zieglerovými–Nattovými katalyzátory. Většinou se používají heterogenní katalyzátory, byly však, obzvláště při stereospecifických polymerizacích, použity i homogenní.[6] Metateze alkenů se v průmyslu obvykle katalyzují heterogenně, jsou však také známé homogenní postupy.[7]
Oxidace
Homogenní katalyzátory se dají využít i u mnoha oxidačních reakcí. Ve Wackerově procesu vzniká acetaldehyd reakcí ethenu s kyslíkem. Využití v katalýze má i mnoho nekovových organických komplexů, například při výrobě kyseliny tereftalové z xylenu. Alkeny lze epoxidovat a dihydroxylovat za použití kovových komplexů, jako například při Sharplessových dihydroxylacích.
Enzymy (včetně metaloenzymů)
Enzymy fungují jako homogenní katalyzátory, které jsou důležité pro živé organismy, mají však i průmyslová využití. Dobře prozkoumaný případ představují karbonátdehydratázy, které katalyzují přenos oxidu uhličitého z krve do plic. Enzymy mají vlastnosti homogenních i heterogenních katalyzátorů, často jsou v tomto smyslu považovány za třetí, oddělenou, skupinu katalyzátorů. Častým reaktantem v enzymatických reakcích je voda. Estery a amidy se v neutrálním prostředí hydrolyzují pomalu, ovšem rychlosti těchto reakcí výrazně zvyšují některé metaloenzymy, což jsou molekuly, které lze považovat za velké komplexy.
Akrylamid se vyrábí enzymaticky katalyzovanou hydrolýzou akrylonitrilu.[8]
Výhody a nevýhody
Výhody
- Homogenní katalyzátory jsou obecně selektivnější než heterogenní.
- U exotermních reakcí přenášejí homogenní katalyzátory teplo do rozpouštědla.
- Homogenní katalyzátory se snadněji přesně charakterizují, jejich reakční mechanismy tak lze snadněji ovládat.[9]
Nevýhody
- Oddělení homogenního katalyzátoru od produktů může být obtížné; u některých vysoce aktivních katalyzátorů se neprovádí. V případě některých jiných reakcí jsou organické produkty dostatečně těkavé, aby mohly být odděleny destilací.
- Homogenní katalyzátory mívají ve srovnání s heterogenními nižší tepelnou stabilitu. Řada organokovových komplex§ se rozkládá za teplot nižších než 100 °C. Existují však i takové, jež lze použít i při teplotách okolo 200 °C.[10]
Reference
V tomto článku byl použit překlad textu z článku Homogeneous catalysis na anglické Wikipedii.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.c00876. (anglicky) DOI: 10.1351/goldbook.
- ↑ P. W. N. M. van Leeuwen; J. C. Chadwick. Homogeneous Catalysts: Activity - Stability - Deactivation. Weinheim: Wiley-VCH, 2011. ISBN 9783527635993.
- ↑ Jerzy Klosin; Philip P. Fontaine; Ruth Figueroa. Development of Group IV Molecular Catalysts for High Temperature Ethylene-α-Olefin Copolymerization Reactions. Accounts of Chemical Research. 2015, s. 2004–2016. DOI 10.1021/acs.accounts.5b00065. PMID 26151395.
- ↑ R. P. Bell "The Proton in Chemistry", Chapman and Hall, London, 1973 DOI: 10.1016/0022-2860(76)80186-X
- ↑ Boy Cornils; Armin Börner; Robert Franke; Baoxin Zhang; Ernst Wiebus; Klaus Schmid. Applied Homogeneous Catalysis with Organometallic Compounds. [s.l.]: [s.n.], 2017. ISBN 9783527328970. DOI 10.1002/9783527651733.ch2. Kapitola Hydroformylation, s. 23–90.
- ↑ Elschenbroich, C. ”Organometallics” (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ↑ Klaus Beckerle, Jun Okuda, Walter Kaminsky, Gerrit A. Luinstra, Moritz C. Baier, Stefan Mecking, Giovanni Ricci, Giuseppe Leone, Leslaw Mleczko, Aurel Wolf, Alexandra Grosse Böwing. Applied Homogeneous Catalysis with Organometallic Compounds. [s.l.]: [s.n.], 2017. DOI 10.1002/9783527651733.ch4. Kapitola Polymerization and Copolymerization.
- ↑ OHARA, Takashi; SATO, Takahisa; SHIMIZU, Noboru. Acrylic Acid and Derivatives. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a01_161. S. a01_161. (anglicky) DOI: 10.1002/14356007.a01_161.
- ↑ G. O. Spessard and G. L. Miessler "Organometallic Chemistry", Prentice Hall, Upper Saddle River, NJ, 1997, pp. 249-251
- ↑ Michael C. Haibach; Sabuj Kundu; Maurice Brookhart; Alan S. Goldman. Alkane Metathesis by Tandem Alkane-Dehydrogenation–Olefin-Metathesis Catalysis and Related Chemistry. Accounts of Chemical Research. 2012, s. 947–958. DOI 10.1021/ar3000713. PMID 22584036.
Externí odkazy
 Obrázky, zvuky či videa k tématu Homogenní katalýza na Wikimedia Commons
Obrázky, zvuky či videa k tématu Homogenní katalýza na Wikimedia Commons
Média použitá na této stránce
Autor: Smokefoot, Licence: CC BY-SA 4.0
cycle for alkene hydrogenation catalyzed by RhCl(PPh3)3
Autor: Smokefoot, Licence: CC BY-SA 3.0
chemical structure of a constrained geometry complex

