Hydroborace
Hydroborace je skupina organických reakcí spočívajících v adici vazeb vodík-bor na dvojné vazby C-C, C-N a C-O a nebo trojné vazby C-C. Hydroborační reakce mají využití v organické syntéze. Za jejich objev a rozvoj organoboranů jako syntetických meziproduktů získal Herbert C. Brown společně s Georgem Wittigem v roce 1979 Nobelovu cenu za chemii.[1][2]
Hydroboracemi vznikají organoborany, jež mohou reagovat s dalšími látkami za vzniku užitečných produktů, jako jsou alkoholy, aminy a halogenalkany. Nejvíce využívaným druhem reakce organoboranů je oxidace za vzniku alkoholů, prováděná například peroxidem vodíku. Tato reakce vyvolala rozvoj výzkumu hydroborací, protože probíhá za mírných podmínek s velkým množstvím použitelných alkenů. Dalším tématem výzkumu jsou kovy katalyzované hydroborace.
Navázání vazby H-B na dvojnou vazbu C-C
Hydroborace obykle probíhají proti Markovnikovu pravidlu, vodík se aduje na nejvíce substitutuovaný uhlík dvojné vazby. Obrácená regiochemie oproti běžné adici HX souvisí s polaritou vazeb Bδ+-Hδ−. Hydroborace probíhají přes čtyřčlenné přechodné stavy: atomy vodíku a boru se vážou na stejnou stranu dvojné vazby. Vzhledem k tomu, že je mechanismus soustředěný, tak tvorba vazeb C-B probíhá o něco rychleji než u vazeb C-H. V důsledku toho se u přechodného stavu na atomu boru tvoří částečný záporný náboj a více substituovaný uhlík má částečný kladný náboj, protože karbokation s nábojem na substituovanějším uhlíku je stabilnější. Reakce formálně patří mezi reakce s přesunem skupiny, analýzou orbitalů však bylo zjištěno, že je pseudopericyklická a neplatí u ní Woodwardova–Hoffmannova pravidla pro pericyklické reakce.

Pokud se jako hydroborační činidlo použije BH3, tak se obvykle vytvářejí monoalkylované borany; to obzvláště platí u méně stericky stíněných malých alkenů. Trisubstituované alkeny snadno tvoří dialkylborany, ovšem další alkylace je kvůli sterickým efektům pomalejší. Tento rozdíl v rychlosti tvorby di-alkyl- a trialkylboranů je výhodný při syntézách objemných boranů, kde může zlepšovat regioselektivitu.
Reakce substituovaných alkenů
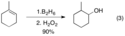
U trisubstituovaných alkenů, jako je 1, se boron přednostně váže na méně substituovaný uhlík.[3]
Podíl druhého produktu, s atomem boru navázaným na více substituovaný uhlík, je obvykle menší než 10 %. Nižší regioselektivity se dosahuje u styrenu, kde je selektivita významně ovlivňována substituentem v poloze para.
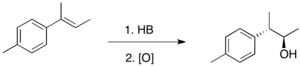
Hydroborace 1,2-disubstituovaných alkenů vede většinou k tvorbě dvou produktů v podobných množstvích , a to i tehdy, když mají substituenty výrazně odlišné sterické efekty. U těchto alkenů lze regioselektivity dosáhnout jen tehdy, je-li jedním ze substituentů fenylová skupina, například u trans-1-fenylpropenu, kde se bor váže na uhlík sousedící s fenylovým substituentem. Výše uvedená pozorování naznačují, že adice vazeb H-B na alkeny jsou řízeny více elektronově než stericky.
Reakce organoboranů
Vazby C-B vytvořené hydroboracemi reagují s mnoha různými sloučeninami, jako například peroxidem vodíku. Jelikož je adice H-B na alkeny stereospecifická, tak bude tato oxidace u trisubstituovaných alkenů diastereoselektivní.[4]
Hydroborace-oxidace jsou tak vhodné k stereospecifické přípravě alkoholů.
Hydroborací lze také připravit aminy reakcemi organoboranových meziproduktů s chloraminem nebo kyselinou O-hydroxylaminsulfonovou.
Koncové alkeny lze přeměnit na odpovídající alkylbromidy a alkyljodidy reakcemi organoboranů s bromem[5] či jodem[6] Tyto reakce se ovšem nestaly oblíbenými, protože sukcinimidové reaktanty, jako jsou NIS a NBS, mají širší využití a používají se za mírnějších podmínek než organoborany.
Adukty boranů
Diboran může být získán redukcí fluoridu boritého (BF3) s tetrahydridoboritanem sodným (NaBH4). Jako zdroj BH3 se ovšem nejčastěji používá komplex BH3S(CH3)2 (BMS).[8] Lze jej získat ve vysoce koncentrované podobě.[9]
Dostupný je také adukt BH3(THF), protože BH3 rozpuštěný v THF vytváří 1:1 adukt; ten se pomalu rozkládá.[10]
Adukty boranu s fosfiny a aminy jsou také dostupné, ovšem využívají se méně.[11]
Boran tvoří silný adukt s triethylaminem; jeho použití vyžaduje tvrdší reakční podmínky, což může být, například při hydroboracích trienů, výhodné, protože se tím zabraňuje polymerizaci. Více stericky ovlivněné terciární aminy a silylaminy mohou navazovat boran na alkeny za pokojové teploty.

Monosubstituované borany
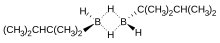
Monoalkylborany jsou poměrně neobvyklé. Pokud je alkylová skupina malá, jako v případě methylu, tal monoalkylborany podléhají redistribučním reakcím za vzniku směsí diboranů a di- a trialkylboranů. Monoalkylborany se obvykle vyskytují jako dimery se vzorcem [RBH2]2; jako příklad lze uvést thexylboran (ThxBH2), připravovaný hydroborací 2,3-dimethylbut-2-enu:[12]
- B2H6 + 2 Me2C=CMe2 → [Me2CHCMe2BH2]2
Chirálním monosubstituovaným boranem je například monoisopinokamfeylboran. I když bývá často popisován vzorcem IpcBH2, tak vytváří dimer [IpcBH2]2. Připravuje se hydroborací (−)‐α‐pinenu borandimethylsulfidem.[13]
Dostupné jsou také sloučeniny typu RBH2, kde R = alkyl nebo halogenid. Monobrom- a monochlorborany je možné připravit reakcí BMS s příslušnými boritými halogenidy. Stabilní komplex monochlorboranu a 1,4-dioxanu usnadňuje hydroboraci koncových alkenů.[14]
Disubstituované borany
Dimesitylboran
Dimesitylboran je dimer se vzorcem (C6H2Me3)2B2H2). S jednoduchými koncovými alkeny reaguje pomalu, zatímco alkyny mohou být pomocí této látky lehce monohydroborovány za vzniku alkenylboranů.[15]
Disiamylboran
Jedním ze stericky ovlivněných dialkylboranů je disiamylboran, zkráceně Sia2BH; stejně jako dimesitylboran vytváří dimer. Vzhledem ke svým sterickým efektům selektivně hydroboruje stericky méně zatížené, časko koncové, alkeny za přítomnosti více substitutovaných alkenů.[16]
Disiamylboran je třeba připravit těsně před použitím, protože jeho roztoky lze skladovat pouze několik hodin při 0 °C. Tepelně stálejší než Sia2BH je dicyklohexylboran (Chx2BH).
9-BBN
Široce použitelným dialkylboranem je 9-borabicyklo(3.3.1)nonan (9-BBN); vyskytující se v podobě dimeru. Lze jej získat destilací za teploty 195 °C a tlaku 1,6 kPa. Reakce využívající 9-BBN obvykle probíhají v rozmezí teplot 60–80 °C, přičemž u většiny alkenů probíhají okolo hodiny. Na tetrasubstituované alkeny se 9-BBN váže za vyšších teplot. Hydroborace alkenů pomocí 9-BBN mívají velmi vysokou regioselektivitu. Látka je více citlivá na sterické efekty než Sia2BH, protože má pevný C8 řetězec. 9-BBN více reaguje s alkeny než s alkyny.[17]
Ostatní sekundární borany
Dialkylborany nevytvářející silné sterické efekty reagují za pokojové teploty s většinou alkenů a koncových alkynů, je ovšem obtížné je získat ve vysoké čistotě, protože tvoří rovnováhu s mono- a trialkylborany. Jedním z možných způsobů jejich přípravy je redukce dialkylhalogenoboranů hydridy kovů.[18]
Dialkylborany, jako je například diethylboran, se využívají při transmetalacích organických sloučenin boru na organozinečnaté sloučeniny.[19][20]
Pinakolboran a katecholboran
Při katalytických hydroboracích se často používají také pinakolboran a katecholboran; vyznačují se vyšší reaktivitou vůči alkynům.[21]
Pinakolboran bývá také používán v bezkatalyzátorových hydroboracích.
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Hydroborace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hydroborace na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Hydroboration na anglické Wikipedii.
- ↑ H. C. Brown. Hydroboration-A Powerful Synthetic Tool. Tetrahedron. 1961, s. 117. DOI 10.1016/0040-4020(61)80107-5.
- ↑ The Nobel Prize in Chemistry 1979 [online]. [cit. 2017-03-21]. Dostupné online.
- ↑ H. C. Brown; G. Zwefei. Isomerization of Organoboranes Derived Addition Mechanism of Isomerization from Branched-Chain and Ring Olefins- Further Evidence for the Elimination-Addition Mechanism of Isomerization. Journal of the American Chemical Society. 1960, s. 1504. DOI 10.1021/ja01491a058.
- ↑ E. L. Allred; J. Sonnenbcrg; S. Winstcin. Preparation of Homobenzyl and Homoallyl Alcohols by the Hydroboration Method. Journal of Organic Chemistry. 1960, s. 25. DOI 10.1021/jo01071a007.
- ↑ H. C. Brown; C. F. Lane. The Base-Induced Reaction of Organoboranes with Bromine. A Convenient Procedure for the Anti-Markovnikov Hydrobromination of Terminal Olefins via Hydroboration-Bromination. Journal of the American Chemical Society. 1970, s. 6660. DOI 10.1021/ja00725a057.
- ↑ H. C. Brown; M. Rathke; M. M. Rogic. A Fast Reaction of Organoboranes with Iodine under the Influence of Base. A Convenient Procedure for the Conversion of Terminal Olefins into Primary Iodides via Hydroboration-Iodination. Journal of the American Chemical Society. 1968, s. 5038. DOI 10.1021/ja01020a056.
- ↑ Robert O. Hutchins; Frank Cistone. Utility and Applications of Borane Dimethylsulfide in Organic Synthesis. A Review. Organic Preparations and Procedures International. 1981, s. 225. DOI 10.1080/00304948109356130.
- ↑ https://www.organic-chemistry.org/chemicals/reductions/boranes.shtm Borane-dimethylsulfide
- ↑ Marek Zaidlewicz; Ofir Baum; Morris Srebnik. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.] DOI 10.1002/047084289X.rb239.pub2. Kapitola Borane Dimethyl Sulfide.
- ↑ J. Kollonitisch. Reductive Ring Cleavage of Tetrahydrofurans by Diborane. Journal of the American Chemical Society. 1961, s. 1515. DOI 10.1021/ja01467a056.
- ↑ B. Carboni; L. Mounier. Recent developments in the chemistry of amine- and phosphine-boranes. Tetrahedron. 1999, s. 1197. DOI 10.1016/S0040-4020(98)01103-X.
- ↑ Ei-Ichi Negishi; Herbert C. Brown. Thexylborane-A Highly Versatile Reagent for Organic Synthesis via Hydroboration. Synthesis. 1974, s. 77–89. DOI 10.1055/s-1974-23248.
- ↑ Raj K. Dhar; Kanth V. B. Josyula; Robert Todd; Pravin D. Gagare; Veeraraghavan Ramachandran. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.] ISBN 9780470842898. DOI 10.1002/047084289X.rd248.pub3. Kapitola Diisopinocampheylborane, s. 1–10.
- ↑ J. V. B. Kanth; H. C. Brown. Hydroboration. 97. Synthesis of New Exceptional Chloroborane−Lewis Base Adducts for Hydroboration. Dioxane−Monochloroborane as a Superior Reagent for the Selective Hydroboration of Terminal Alkenes. Journal of Organic Chemistry. 2001, s. 5359–5365. DOI 10.1021/jo015527o. PMID 11485456.
- ↑ A. Pelter; S. Singaram; H. C. Brown. The Dimesitylboron Group in Organic Chemistry. 6 Hydroborations with dimesitylborane. Tetrahedron Letters. 1983, s. 1433. DOI 10.1016/S0040-4039(00)81675-5.
- ↑ D. S. Dodd; A. C. Ochlschlager. Synthesis of inhibitors of 2,3-oxidosqualene-lanosterol cyclase: conjugate addition of organocuprates to N-(carbobenzyloxy)-3-carbomethoxy-5,6-dihydro-4-pyridone. Journal of Organic Chemistry. 1992, s. 2794. DOI 10.1021/jo00036a008.
- ↑ R. S. Dhillon. Hydroboration and Organic Synthesis : 9-Borabicyclo [3.3.1] Nonane (9-BBN). [s.l.]: Springer, 2007.
- ↑ H. C. Brown; S. U. Kulkarni. Organoboranes: XXV. Hydridation of dialkylhaloboranes. New practical syntheses of dialkylboranes under mild conditions. Journal of Organometallic Chemistry. 1981, s. 299. DOI 10.1016/S0022-328X(00)81001-3.
- ↑ A. Boudier; E. Hupe; P. Knochel. Highly Diastereoselective Synthesis of Monocyclic and Bicyclic Secondary Diorganozinc Reagents with Defined Configuration. Angewandte Chemie International Edition. 2000, s. 2294. DOI 10.1002/1521-3773(20000703)39:13<2294::AID-ANIE2294>3.0.CO;2-J.
- ↑ E. Hupe; P. Knochel. Stereoselective Synthesis of Secondary Organozinc Reagents and Their Reaction with Heteroatomic Electrophiles. Organic Letters. 2001, s. 127–130. DOI 10.1021/ol0068400. PMID 11429854.
- ↑ H. C. Brown; M. Zaidlewicz. Organic Syntheses Via Boranes, Vol. 2. Milwaukee: Aldrich Chemical, 2001. ISBN 978-0-9708441-0-1.
Média použitá na této stránce
structure of thexylborane
Autor: Mengfei zhang, Licence: CC BY-SA 3.0
Examples of amine borane complexes
structure of BH3SMe2
Autor: Mengfei Zhang, Licence: CC BY-SA 3.0
Hydroboration-Oxidation of 1-methyl-cyclohex-1-ene
Autor: Mengfei Zhang, Licence: CC BY-SA 3.0
Hydroboration-Oxidation of (E)-prop-1-en-1-ylbenzene
Autor: Smokefoot, Licence: CC BY-SA 3.0
hydroboration mech, with improved concept of transition state showing developing carbocation
Autor: Mengfei zhang, Licence: CC BY-SA 3.0
Regiospecific hydroboration with borane-(1)
Autor: Mengfei zhang, Licence: CC BY-SA 3.0
General stereoselectivity of Hydroboration