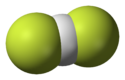Hydrogendifluorid amonný
| Hydrogendifluorid amonný | |
|---|---|
 Pevný hydrogendifluorid amonný | |
| Obecné | |
| Systematický název | Hydrogendifluorid amonný |
| Ostatní názvy | Bifluorid amonný |
| Anglický název | Ammonium bifluoride |
| Německý název | Ammoniumhydrogendifluorid |
| Sumární vzorec | NH4HF2 |
| Vzhled | bezbarvá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 1341-49-7 |
| PubChem | 14935 |
| SMILES | [NH4+].F[H-]F |
| InChI | InChI=1S/F2H.H3N/c1-3-2;/h;1H3/q-1;/p+1 |
| Vlastnosti | |
| Molární hmotnost | 57,044 g/mol |
| Teplota tání | 126 °C |
| Teplota varu | 240 °C |
| Hustota | 1,50 g·cm−3 |
| Index lomu | 1,390 |
| Rozpustnost ve vodě | 63 g/100 g H2O (20 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Hydrogendifluorid amonný je anorganická sloučenina se vzorcem NH4HF2, příp. NH4F·HF. Vzniká reakcí amoniaku a fluorovodíku. Tato bezbarvá sůl leptá sklo a je meziproduktem v jedné z možných příprav kyseliny fluorovodíkové.
Struktura
Hydrogendifluorid amonný se skládá z tetraedrického amonného kationtu a centrosymetrického hydrogendifluoridového aniontu. Anion obsahuje nejsilnější známou vodíkovou vazbu F-H, její vazebná energie je vyšší než 155 kJ.mol−1.[2]
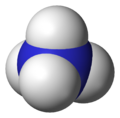
- Amonný kation
- Hydrogendifluoridový anion
Výroba a využití
Je součástí leptacích přípravků, s oxidem křemičitým reaguje podle rovnice:
- SiO2 + 4 [NH4][HF2] → SiF4 + 4 NH4F + 2 H2O
Hydrogendifluorid amonný je meziproduktem jedné z metod přípravy kyseliny fluorovodíkové z kyseliny hexafluorokřemičité. Ta po hydrolýze poskytuje fluorid amonný, který se termicky převede na hydrogendifluorid:
- H2SiF6 + 6 NH3 + 2 H2O → SiO2 + 6 NH4F
- 2 NH4F → NH3 + [NH4][HF2]
Vzniklý hydrogendifluorid amonný se převede na sodnou sůl a termicky se z něj uvolní HF.[3]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Ammonium bifluoride na anglické Wikipedii.
- ↑ a b Ammonium bifluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ GREENWOOD, N. N. (NORMAN NEILL). Chemistry of the elements. 2. vyd. Oxford: Butterworth-Heinemann xxii, 1341 pages s. ISBN 0750633654, ISBN 9780750633659. OCLC 37499934 S. 61.
- ↑ AIGUEPERSE, Jean; MOLLARD, Paul; DEVILLIERS, Didier. Fluorine Compounds, Inorganic. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 9783527306732. doi:10.1002/14356007.a11_307. (anglicky) DOI: 10.1002/14356007.a11_307.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Autor: LHcheM, Licence: CC BY-SA 3.0
Vzorek hydrogendifluoridu amonného