Interferon



Interferony (IFN) jsou skupinou cytokinů, konkrétně patří mezi cytokiny druhé třídy spolu s interleukinem-10, interleukinem-19, interleukinem-20 a dalšími cytokiny. Hrají důležitou roli v regulacích imunitního systému, buněčné proliferace a diferenciace, či angiogeneze. Jedná se o glykoproteiny produkované především buňkami imunitního systému, ale i jinými buněčnými typy jako jsou například fibroblasty. Jejich syntéza je vyvolána patogenními, nádorovými či mitogenními podněty. Existují tři skupiny interferonů, přičemž všechny interferony se do určité míry podílejí na antivirové odpovědi imunitního systému a svým působením na buňky v nich vyvolávají antivirový stav. Vzájemně se ale liší proteinovou sekvencí i receptorem.
Jako první byly objeveny interferony prvního typu a to v roce 1957 jako biomolekuly se silnou antivirovou aktivitou[1].
Typy interferonů a jejich funkce
Byly definovány tři skupiny interferonů: interferony typu I, interferony typu II a nedávno popsané interferony typu III.
Interferony typu I
U lidí je 18 různých interferonů I. prvního typu. Největší podkupinu tvoří IFN-α, který má celkem 13 podtypů – IFN-α1, IFN-α2, IFN-α4, IFN-α5, IFN-α6, IFN-α7, IFN-α8, IFN-α10, IFN-α13, IFN-α14, IFN-α16, IFN-α17 a IFN-α21. Dále jsou u lidí IFN-β, IFN-ε, IFN-κ a IFN-ω. Geny, které je kódují jsou v lidském genomu na 9. chromosomu. Všichni členové jsou monomery a mají silné antivirové schopnosti zahrnující inhibici virové replikace, stimulaci aktivity NK buněk, zvýšení povrchové exprese MHC I molekul a tím i prezentace antigenů cytotoxickým T buňkám (CD8+ T buňky).[2][3][4] Jejich produkce je primárně vyvolaná virovou infekcí, ale může být stimulovaná také infekcí bakteriální, zánětlivými reakcemi, UV zářením apod.[5] IFN-α a IFN-β jsou důležitými regulátory TH2 a TH17 odpovědí, což může hrát důležitou roli při léčbě atopií a autoimunitních reakcí.[6]
- Rodina interferonu α (IFN-α)
Jedná se o skupinu 13 glykoproteinů syntetizovaných leukocyty po antigenní stimulaci. Jsou kódovány bezintronovými geny ležícími na lidském chromozomu 9 a myším chromozomu 4. Členové této rodiny mají důležitou roli v inhibici virové replikace, mají antiproliferativní schopnosti a mohou vyvolávat horečku. Stimulují NK buňky a indukují expresi MHC I molekul. Jsou většinou druhově specifické. Receptor pro IFN-α (a IFN-β) je složen ze dvou podjednotek, IFNAR1 a IFNAR2.
- Interferon β (IFN-β)
Tento glykoprotein je produkovaný fibroblasty v přímé odpovědi na virovou infekci. Jeho aminokyselinová sekvence a struktura je velmi podobná IFN-α, sdílejí stejný receptor a indukují v podstatě stejné signály. Gen, který jej kóduje, se nalézá stejně jako geny pro INF-α na lidském chromozomu 9 a myším chromozomu 4. Stejně jako IFN-α má antivirové vlastnosti a vyznačuje se schopností navodit v buňkách virovou rezistenci.[2][3]
Interferony typu II
Skupina interferonů typu II je tvořena pouze jedním členem, a to IFN-γ. V lidském genomu je kódován na 12. chromozomu. Jedná se o homodimerní glykoprotein, jehož produkce cytotoxickým T buňkami, TH1 buňkami nebo NK buňkami je spíše než virovými stimuly indukována rozpoznáním infikované nebo atypické buňky. Jeho sekrece z buněk je výrazně zvýšená v přítomnosti IL-12 a IL-18, produkovanými aktivovanými antigen-prezentujícími buňkami (APC). Stejně jako interferony typu I má antiproliferativní a antivirové účinky, ale na rozdíl od předchozí skupiny je schopen nejen stimulovat expresi MHC I molekul, ale u řady buněk stimuluje i expresi molekul MHC II a tím zvyšovat prezentaci antigenů pomocným T buňkám (CD4+ T buňky). Aktivuje mononukleární fagocyty a zvyšuje jejich schopnost ničit intracelulární mikroorganismy a nádorové buňky, stimuluje NK buňky, neutrofily a vaskulární endoteliální buňky.[2][3][4][7] Hladina INF-γ je snížená při chronické lymfocytární leukémii, lymfomu a IgA deficienci, také u lidí infikovaných zarděnkami, EBV a cytomegalovirem. Je kódovaný genem na lidském chromozomu 12 a na myším chromozomu 10.Receptor INF-γ je heterotetramer skládající se z homodimerních podjednotek IFNGR1, která je důležitá pro vazbu INF-γ, a IFNGR2, jež zprostředkovává signalizaci. IFNGR byl identifikován na všech buňkách kromě erytrocytů. Dokonce i krevní destičky jej nesou na svém povrchu.
Interferony typu III
Zahrnují rodinu IFN-λ (také IL-28/29), která má podobné antivirové vlastnosti jako interferony typu I. Byla identifikována na přelomu 2002/2003. V závislosti na jejich struktuře, receptorech a biologické aktivitě se dělí na tři typy: IL-29, IL-28A a IL-28B. Všechny typy mají vliv jak na vrozenou, tak na adaptivní odpověď, a jsou produkovány leukocyty společně s interferony typu I v přímé reakci na virovou infekci.[8][9]
Funkčně jsou velmi podobné interferonům typu I, ale mají odlišný receptor a geny, které je kódují, mají jinou strukturu. Receptor IFN-λ je heterodimerní a skládá se z unikátního IFN-λR1 řetězce a IL-10R2 řetězce, jenž se nachází také v receptorových komplexech pro IL-10, IL-22 a IL-26. Exprese receptoru je tkáňově specifická. Geny kódující členy rodiny IFN-λ leží na lidském chromozomu 19 a myším chromozomu 7 a na rozdíl od genů pro interferony typu I obsahují introny. Stejně jako interferony typu I zvyšují expresi MHC I molekul a mají antiproliferativní účinky.
Jejich imunomodulační funkce ještě nebyly jasně definovány, nicméně jsou důležitými mediátory antivirové odpovědi ve tkáních sliznic a epitelů a hrají významnou roli v ochraně epitelu gastrointestinálního traktu. Jsou aktivní v plicním epitelu a hrají významnou roli v odpovědích na respirační virové infekce.
| typ IFN | molekula | Receptorové podjednotky | Signální dráha |
I. | IFN-α | IFN-αR1, IFN-αR2 | Jak1, Tyk2 |
| IFN-β | Stat1, Stat2, Stat3 | ||
| IFN-ε | PI3K | ||
| IFN-κ | Akt | ||
| IFN-ω | MAPK | ||
II. | IFN-γ | IFN-γR1, IFN-γR2 | Jak1, Jak2, Stat1, Stat3, Stat5, PI3K, Akt, NFκB, MAPK |
III. | IFN-λ1 | IL-28R1, IL-10R2 | Stat5 |
| IFN-λ2 | Jak1, Tyk2 | ||
| IFN-λ3 | Stat1, Stat2, Stat3 | ||
| IFN-λ4 |
Signalizace
Po vazbě na své specifické receptory na povrchu buněk spouští interferony kaskádu reakcí, jejichž výsledkem je stimulace exprese IFN-inducibilních genů, které jsou za normálních okolností umlčené nebo jsou exprimované ve velmi nízkých hladinách. Signalizační dráhy zapojené do reakcí indukovaných interferony jsou známé jako Jak/STAT dráhy.[2][4]
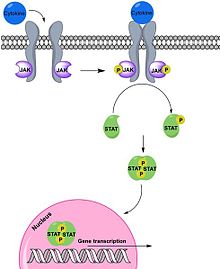
Interferony prvního typu se vážou na transmembránový receptor složený ze dvou podjenotek[11]. IFNα/β se naváže nejprve na podjednotku IFNαR2, ke které má větší afinitu a teprve poté dojde k vazbě i na druhou podjednotku. Podjednotky receptoru IFNAR pak asociují a přenáší signál dál. Transaktivují receptorové kinázy tyrosin kináz Tyk 2 a Jak 1. Ty fosforylují a tím aktivují transkripční faktory STAT1 a STAT2 (z anglického signal transducer and activator of transcription). Aktivované proteiny poté dimerizují a translokují do jádra za současného navázání DNA vázajícího proteinu p48 (také znám jako IRF 9, Interferon regulatory factor 9) a vzniká heterotrimerní komplex ISGF3 (Interferon stimulated gene factor 3). Komplex se váže na regulační sekvenci ISRE (Interferon-sensitive response element), která se nachází ve většině genů indukovaných IFNα/β, a dochází ke spuštění exprese genových produktů. Kromě homodimerů STAT1 a heterofimerů STAT1-STAT2 mohou při signalizaci interferonů prvního typu vznikaj i další kombinace dimerů: STAT1–STAT1, STAT3–STAT3, STAT4–STAT4, STAT5–STAT5, STAT6–STAT6, STAT1–STAT3, STAT1–STAT4, STAT1–STAT5, STAT2–STAT3 a STAT5–STAT6. Dimery se také přemisťují do jádra a tam se vážou na část promotoru ISGs zvanou interferonem gama aktivovaný element a také dochází ke spuštění exprese genových produktů.
Signalizace IFN-γ přes receptor IFNGR je obdobná. Po vazbě ligandu dochází k dimerizaci receptoru, transaktivaci receptorových tyrosin kináz Jak1 a Jak2, které fosforylací dalších členů signální kaskády umožňují aktivaci STAT1 molekul. Následně dochází k homodimerizaci STAT1 za vzniku faktoru GAF (Gamma activated factor), disociaci od receptoru a přechodu do jádra, kde se váže na GAS (Gamma activation sequence), regulační sekvenci genů indukovaných IFN-γ, a stimuluje expresi genových produktů. IFN-λ signalizační dráhy jsou velmi podobné s drahami indukovanými IFNα/β.
Význam v léčbě
Díky svým antivirovým vlastnostem a imunomodulačním schopnostem jsou interferony využívané v klinické praxi pro léčbu některých nemocí s větší či menší úspěšností.[7]
IFN-α se využívá při léčbě hepatitidy typu C a B a má spoustu různých využití v terapii nádorů, např. v léčbě B buněčné leukemie (Hairy cell leukemia), chronické myeloidní leukémie nebo Kaposiho sarkomu. Obchodní název léčiva je Roferon nebo Intron-A. Léčba má ovšem řadu vedlejších efektů včetně chřipkových příznaků, depresí až sebevražd, supraventrikulární tachykardii a může dokonce dojít i k úbytku kostní dřeně a městnavému selhání srdce.
IFN-β byl jedním z prvních léčiv schopných navodit klinické zlepšení u roztroušené sklerózy. Obchodní název IFN-β1a používaného pro léčbu je Avonex. Stejně jako IFN-α i léčba IFN-β má mnohé vedlejší účinky, mezi nejčastějčí patří chřipkové symptomy, potenciálně se pak mohou vyskytnout např. poruchy nálad, alergie, křeče nebo srdeční potíže.[12]
IFN-γ se používá pro léčbu chronické granulomatózní choroby (CGD), při níž nejsou schopny fagocyty zabíjet pohlcené mikroorganismy. Má také příznivý efekt při léčbě osteoporózy a byl s různým stupněm účinnosti využíván k léčbě Hodgkinova lymfomu, kožního T buněčného lymfomu a mnohočetného myelomu. Obchodní název léčiva užívaného při léčbě CGD a osteoporózy je Actimmune. Tak, jako u IFN-α a IFN-β terapie, i v případě léčby IFN-γ se objevují vedlejší účinky. Běžné jsou chřipkové symptomy, mohou se ale vyskytnout závažnější poruchy včetně kardiovaskulárních onemocnění, neurologických poruch, poškození kostní dřeně nebo jaterních poruch.[13]
PEGylovaný IFN-λ v současné době prochází klinickými studiemi zaměřenými na léčbu chronické hepatitidy typu C. Bylo také prokázáno, že IFN-λ inhibuje replikaci viru hepatitidy typu B v různých typech myších hepatocytárních linií. Díky tkáňově specifické expresi jeho receptorů se předpokládá, že by mohl mít při podání pacientům slabší vedlejší účinky vyskytující se v mnohem menší míře než je tomu např. u terapie IFN-α. Mezi další možné aplikace IFN-λ v klinické praxi je léčba a/nebo prevence respirativních a gastrointestinálních virových onemocnění a možná i astmatu. Potenciálně by mohl být také využit pro léčbu malignit, jelikož v myších nádorových modelech i liniích melanomů a kolorektálního karcinomu vykazoval protinádorovou aktivitu.[8][9]
Antivirová odpověď a rezistence virů k interferonům
V odpovědi na virovou infekci produkují buňky ovlivněné interferony především protein kinázu K (PKR) a endoribonukleázu L (RNázu L), dále molekuly regulující buněčný cyklus a apoptózu. Jako kofaktor pro spuštění exprese IFN-inducibilních proteinů funguje dsRNA.[8][9]
PKR je dimerní enzym, který po aktivaci dsRNA působí na translační faktory buňky a v konečném důsledku dochází k inhibici translace. Podílí se také na zvýšené aktivaci transkripčního faktoru NF-κB, což vede ke zvýšené produkci cytokinů, chemokinů a MHC I molekul. Má roli i v indukci apoptotických dějů v buňce. Sám o sobě nestačí ke vzniku plnohodnotné antivirové odpovědi.
RNáza L katalyzuje štěpení ssRNA (včetně mRNA) a 28S rRNA, čímž následně dochází k inhibici translace inaktivací ribozomů a inhibicí syntézy proteinů. Hraje roli v indukci apoptózy.
Mezi další enzymy uplatňující se v antivirové odpovědi patří např. také IFN-inducibilní Mx proteiny, které interferují s virovou replikací, kaspázy, hrající roli v indukci apoptózy, nebo ADAR (dsRNA-dependentní adenosin deamináza), která vyměňuje v dsRNA adenosin za inosin a tím způsobuje její rozplétání.[2]
Nedílnou roli v antivirové odpovědi mají také antiproliferativní vlastnosti interferonů. Interferony jsou schopny inhibovat růst buněk a tím i replikaci některých virů zvýšením hladiny inhibitorů cyklin-dependentní kinázy p21, která hraje významnou roli při přechodu buňky z G1 do S fáze, a důsledkem toho dochází k blokaci buněčného cyklu.
Jako další zbraň, kterou mohou interferony použít v boji proti virové nákaze je indukce apoptózy buď prostřednictvím PKR a RNázy L, nebo indukcí kaspázy 1, 3, 7 a 8. IFN-γ je schopen také indukovat expresi Fas a FasL molekul.
Virová rezistence k interferonům
Řada virů v odpovědi na IFN-indukovanou imunitní odpověď vyvinula specifické mechanismy interferující s produkcí a aktivitou interferonů. Nicméně, tato protiopatření nejsou ve většině případu schopna absolutně blokovat aktivitu interferonů a konečný výsledek reakce mezi infekcí a IFN-indukovanou odpovědí záleží na rychlosti a efektivitě, s jakou daný virus IFN-indukovanou odpověď obchází a na rychlosti vývoje a nástupu adaptivní odpovědi v těle hostitele.[2]
Jako jeden z mechanismů inhibice indukce interferonové odpovědi je u některých virů produkce proteinů vázajících dsRNA a tím inhibice dsRNA-dependentní aktivace antivirových enzymů, jako jsou PKR nebo RNáza L, a dsRNA-dependentní aktivace apoptotických dějů v buňce. Jiné viry zase produkují inhibitory transkripčních faktorů podílejících se na signalizačních drahách interferonů (např. NF-κB), inhibitory apoptózy, mohou snižovat produkci hostitelské mRNA a tím inhibovat syntézu proteinů včetně interferonů.
Další možností virů je inhibice interferonové signalizace. Děje se tak sekrecí virových solubilních receptorů pro interferony, které je vážou a blokují jejich funkce, snižováním hladin Jak tyrosinových kináz, cílením STAT molekul k degradaci v proteasomu apod.
Reference
- ↑ Virus interference. I. The interferon. Proceedings of the Royal Society of London. Series B - Biological Sciences. 1957-09-12, roč. 147, čís. 927, s. 258–267. Dostupné online [cit. 2020-01-25]. ISSN 2053-9193. DOI 10.1098/rspb.1957.0048.
- ↑ a b c d e f Goodbour, S., Didcock, L., Randall, R.E. (2000): Interferons: Cell Signalling, Immuno Modulation, Antiviral Responses and Virus Countermeasures. Journal of general virology, 81:2341-2364. [1]PMID 10993923.
- ↑ a b c Cruse, J.M., Lewis, R.E. (2003): Atlas of immunology, 2nd edition. CRC press. ISBN 0-8493-1567-0.
- ↑ a b c Williams, P.E. (2003): Fundamental immunology, 5th edition. Lippincott Williams & Wilkins. ISBN 0-7817-3514-9.
- ↑ De Maeyer, E., De Maeyer-Guignard, J. (1998): Type I interferons. International Reviews of Immunology, 17:53-73. PMID 9914943.
- ↑ Huber, J.P., Tartar, J.D. (2011): Regulation of effector and memory T-cell functions by type I interferon. Immunology, 132: 466-74. [2]PMID 2132.
- ↑ a b Goldsby, R.A., Kindt, T.J., Osborne, B.A., Kuby, J. (2002): Immunology, 5th edition. W. H. Freeman. ISBN 0-7167-4947-5.
- ↑ a b c Kotenko, S.V. (2011): IFN-λs. Current Opinion in Immunology, 23:583-90. PMID 21840693.
- ↑ a b c Lasfar, A., Abushahba, W., Murugabaskar, B., Cohen-Solal, K.A. (2011): Interferon Lambda: A new sword in cancer immunotherapy. Clinical and Developmental Immunology, 2011:349575. [3]PMID 22190970.
- ↑ PESTKA, Sidney; KRAUSE, Christopher D.; WALTER, Mark R. Interferons, interferon-like cytokines, and their receptors. Immunological Reviews. 2004-12, roč. 202, čís. 1, s. 8–32. Dostupné online [cit. 2020-01-25]. ISSN 0105-2896. DOI 10.1111/j.0105-2896.2004.00204.x.
- ↑ PLATANIAS, Leonidas C. Mechanisms of type-I- and type-II-interferon-mediated signalling. Nature Reviews Immunology. 2005-05, roč. 5, čís. 5, s. 375–386. Dostupné online [cit. 2020-01-25]. ISSN 1474-1733. DOI 10.1038/nri1604.
- ↑ http://www.avonex.com
- ↑ http://www.actimmune.com
Média použitá na této stránce
Autor: Nevit Dilmen, Licence: CC BY-SA 3.0
1AU1_Human_Interferon-Beta
Autor: Nevit Dilmen, Licence: CC BY-SA 3.0
1RH2 Recombinant Human Interferon Alpha 2b
Autor: Pharmstudice, Licence: CC BY-SA 4.0
When a cytokine binds to a receptor connected to a JAK, receptor subunits dimerize. This brings JAKs connected to each subunit close together, activating a series of phosphorylations by the kinases which activate intracellular signals, in the end leading to phosphorylation of STATs. Activated STATs dimerize and migrate into the nucleus, where they bind to DNA and affect gene transcription.



