Isochinolin
| Isochinolin | |
|---|---|
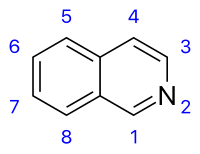 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | isochinolin |
| Ostatní názvy | benzo[c]pyridin, 2-benzazin |
| Sumární vzorec | C9H7N |
| Vzhled | bezbarvá kapalina (nad teplotou tání)[1] |
| Identifikace | |
| Registrační číslo CAS | 119-65-3 21364-46-5 (hydrochlorid) |
| EC-no (EINECS/ELINCS/NLP) | 204-341-8 |
| PubChem | 8405 |
| ChEBI | 28534 |
| SMILES | C1=CC=C2C=NC=CC2=C1 |
| InChI | 1S/C9H7N/c1-2-4-9-7-10-6-5-8(9)3-1/h1-7H |
| Vlastnosti | |
| Molární hmotnost | 129,16 g/mol |
| Teplota tání | 26 °C (299 K)[1] |
| Teplota varu | 243,2 °C (514,4 K)[1] |
| Hustota | 1,10 g/cm3[1] |
| Rozpustnost ve vodě | 0,452 g/100 ml[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H302 H311 H315 H319[1] |
| P-věty | P264+265 P270 P280 P301+317 P302+352 P305+351+338 P312 P321 P330 P332+317 P337+317 P361+364 P362+364 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Isochinolin je dusíkatá heterocyklická aromatická sloučenina, strukturní izomer chinolinu – obě tyto sloučeniny patří mezi benzopyridiny, látky s molekulami složenými z benzenových kruhů napojených na pyridin. Jako isochinoliny se označují i deriváty tohoto „základního“ isochinolinu. 1-benzylovaný derivát je součástí některých alkaloidů, například papaverinu, kde isochinolinový kruh vzniká z aromatické aminokyseliny tyrosinu.[2][3][4][5][6][7]
Vlastnosti
Isochinolin je za teplot nad bodem tání bezbarvou, hygroskopickou a zapáchající kapalinou. Nečisté vzorky mohou být, jak je u dusíkatých heterocyklů obvyklé, zbarvené dohněda. Krystalická podoba je obtížně rozpustná ve vodě, ale dobře se rozpouští v ethanolu, acetonu, diethyletheru, sirouhlíku a dalších běžných organických rozpouštědlech. Ve zředěných kyselinách vytváří protonovanou formu.
Jako analog pyridinu je isochinolin slabou zásadou, pKa jeho konjugované kyseliny činí 5,14.[8] Za přítomnosti silných kyselin, například HCl, je protonován a vytváří soli. Také vytváří adukty s Lewisovými kyselinami, jako je BF3.
Výroba
Isochinolin byl poprvé získán v roce 1885, a to izolací z uhelného dehtu.[9][10] Izolace byla provedena frakční krystalizací síranu. V roce 1914 byl nalezen rychlejší postup spočívající v selektivní extrakci z dehtu, kde se využila skutečnost, že isochinolin je silnější zásadou než chinolin; isochinolin tak lze izolovat lze směsi frakční krystalizací síranu.
Deriváty isochinolinu lze připravit řadou způsobů, ale pro samotný isochinolin jich je méně. Účinný postup představuje Pomeranzova–Fritschova reakce, kdy reaguje benzaldehyd s diethylacetalem aminoacetaldehydu v kyselém prostředí za vzniku isochinolinu.[11] Je také možné použít benzylamin a acetal glyoxalu.[12]
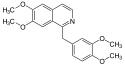
Deriváty isochinolinu se dají vytvořit i jinými postupy. V Bischlerově–Napieralského reakci je fenylethylamin acylován a cyklodehydratován Lewisovou kyselinou, například trichloridem fosforylu nebo oxidem fosforečným. Vzniklý 1-substituovaný 3,4-dihydroisochinolin se poté dehydrogenuje za přítomnosti palladia. Níže je zobrazena Bischlerova–Napieralského reakce vytvářející papaverin:
Obměnami Bischlerovy-Naperialského reakce jsou Pictetova–Gamsova a Pictetova–Spenglerova reakce. Pictetovy–Gamsovy reakce se od Bischlerových-Naperialského liší pouze přítomností hydroxylové skupiny na reaktantu, která umožňuje dehydrataci za stejných podmínek, za kterých probíhá cyklizace, aniž by byla potřeba další reakce převádějící dihydroisochinolin na výsledný produkt.
Při Pictetových–Spenglerových reakcích spolu kondenzují fenylethylamin a aldehyd za tvorby iminu, který je následně cyklizován na tetrahydroisochinolin namísto dihydroisochinolinu. Pictetovy-Spenglerovy reakce mohou probíhat i biologicky, přičemž jako katalyzátor působí enzym (S) (EC 4.2.1.78):
Isochinoliny lze získat i vnitromolekulárními aza-Wittigovými reakcemi.
Využití derivátů
Isochinoliny mají mnoho využití, například:
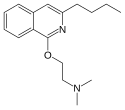
- anestetika, například dimethisochin:
- antihypertenziva, jako jsou chinapril a debrisochin (obě uvedené látky jsou odvozeny od 1,2,3,4-tetrahydroisochinolinu).
- antiretrovirotika, například sachinavir, obsahující isochinolylové funkční skupiny:
- vazodilatancia, jako je papaverin:
Sloučeniny obsahující bisbenzylisochinoliniové kationty se strukturou podobají tubokurarinu. V jejich molekulách se nachází dvě isochinoliniové jednotky, jež jsou propojeny uhlíkatými řetězci obsahujícími dvě esterové vazby.
V lidském těle
Parkinsonovu nemoc pravděpodobně způsobují určité neurotoxiny; v roce 1980 byla zjištěna souvislost s touto nemocí u látky nazývané MPTP (1-methyl-4-fenyl-1,2,3,6-tetrahydropyridin), prekurzor kationtu MPP+. Aktivní neurotoxiny poškozují dopaminergní neurony, toto poškození vede k rozvoji Parkinsonovy nemoci; podobné neurochemické účinky mohou mít i některé další tetrahydroisochinoliny, přičemž mohou fungovat jako prekurzory i jako aktivní neurotoxiny.[13]
Ostatní použití
Isochinoliny se používají na výrobu barviv, insekticidů a fungicidů. Isochinolin je používán jako rozpouštědlo při extrakcích pryskyřic a terpenů a jako inhibitor koroze.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Isoquinoline na anglické Wikipedii.
- ↑ a b c d e f g h i https://pubchem.ncbi.nlm.nih.gov/compound/8405
- ↑ Gilchrist, T. L. (1997) Heterocyclic Chemistry (3rd ed.). Essex, UK: Addison Wesley Longman.
- ↑ Harris, J.; Pope, W. J. „isoQuinoline and the isoQuinoline-Reds“ Journal of the Chemical Society (1922) volume 121, pp. 1029–1033
- ↑ Katritsky, A. R.; Pozharskii, A. F. (2000) Handbook of Heterocyclic Chemistry (2nd ed.) Oxford, UK: Elsevier
- ↑ Katritsky, A .R.; Rees, C. W.; Scriven, E. F. (Eds.). (1996) Comprehensive Heterocyclic Chemistry II: A Review of the Literature 1982–1995 (Vol. 5) Tarrytown, NY: Elsevier
- ↑ Nagatsu, T. „Isoquinoline neurotoxins in the brain and Parkinson's disease“ Neuroscience Research (1997) volume 29, pp. 99–111
- ↑ O'Neil, Maryadele J. (Ed.) (2001). The Merck Index (13th ed.). Whitehouse Station, NJ: Merck
- ↑ Brown, H. C., et al., Baude, E. A. Nachod, F. C., Determination of Organic Structures by Physical Methods, Academic Press, New York, 1955
- ↑ S. Hoogewerf and W. A. van Dorp (1885) „Sur un isomére de la quinoléine“, Recueil des Travaux Chemiques des Pays-Bas, vol.4, no. 4, 125–129
- ↑ S. Hoogewerf and W. A. van Dorp (1886) „Sur quelques dérivés de l'isoquinoléine“, Recueil des Travaux Chemiques des Pays-Bas, vol.5, no. 9, 305–312.
- ↑ J. J. Li. Name Reactions: A Collection of Detailed Mechanisms and Synthetic Applications. [s.l.]: [s.n.], 2014. ISBN 9783319039794. Kapitola Pomeranz–Fritz reaction, s. 490–491.
- ↑ J. J. Li. Name Reactions: A Collection of Detailed Mechanisms and Synthetic Applications. [s.l.]: [s.n.], 2014. ISBN 9783319039794. Kapitola Schlittler–Müller modification, s. 492.
- ↑ Toshimitsu Niwa; Mitsuharu Kajita; Toshiharu Nagatsu. Pharmacology of Endogenous Neurotoxins. [s.l.]: [s.n.], 1998. ISBN 978-1-4612-7375-2. DOI 10.1007/978-1-4612-2000-8_1. Kapitola Isoquinoline Derivatives, s. 3–23.
Související články
- Eletefin, isochinolinový alkaloid
- Naftalen, analog neobsahující atom dusíku
Externí odkazy
 Obrázky, zvuky či videa k tématu Isochinolin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Isochinolin na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Structure of papaverine
Skeletal formula of quinisocaine (INN, also known as dimethisoquin). Created using ACD/ChemSketch 10.0 and Inkscape.
Skeletal formula of saquinavir (original brand name Invirase)—a protease inhibitor used in the treatment of HIV infection. Created with ChemDoodle 8.0.0.b1 and Adobe Illustrator CC 2015.
Pictet-Gams modification of the Bischler-Napieralski reaction
Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the isoquinoline molecule, a nitrogen heterocycle and simple aromatic ring.
Colour code:
- Carbon, C: black
- Hydrogen, H: white
- Nitrogen, N: blue
Pomeranz-Fritsch reaction for isoquinoline synthesis, simple
Isoquinoline structure, numbered
Autor: Gilded Snail, Licence: CC BY-SA 4.0
Biosynthesis of (S)-norcoclaurine from dopamine (4-(2-aminoethyl)benzene-1,2-diol) and 4-hydroxyphenylacetaldehyde with concomitant release of water. This is done by the enzyme (S)-norcoclaurine synthase.
Autor: Gilded Snail, Licence: CC BY-SA 4.0
Illustration of steps in a synthesis of papaverine, including a Bischler-Naperialski reaction