Izoforon
| Izoforon | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | 3,5,5-trimethylcyklohex-2-en-1-on |
| Ostatní názvy | izoacetoforon |
| Anglický název | Isophorone |
| Sumární vzorec | C9H14O |
| Vzhled | bezbartvá až nažloutlá kapalina |
| Identifikace | |
| Registrační číslo CAS | 78-59-1 |
| PubChem | 6544 |
| SMILES | O=C1\C=C(/CC(C)(C)C1)C |
| InChI | InChI=1/C9H14O/c1-7-4-8(10)6-9(2,3)5-7/h4H,5-6H2,1-3H3 |
| Vlastnosti | |
| Molární hmotnost | 138,207 g/mol |
| Teplota tání | −8,1 °C (265,0 K) |
| Teplota varu | 215,32 °C (488,47 K) |
| Hustota | 0,9255 g/cm3 |
| Dynamický viskozitní koeficient | 2,62 cP |
| Index lomu | 1,4766 |
| Rozpustnost ve vodě | 1,2 g/100 ml |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu a ethanolu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu, diethyletheru, hexanu, dichlormethanu a toluenu |
| Tlak páry | 40 Pa (20 °C) |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | 43,4 kJ/mol |
| Bezpečnost | |
| [1] Varování[1] | |
| Teplota vzplanutí | 84 °C (357 K) |
| Teplota vznícení | 460 °C (733 K) |
| Meze výbušnosti | 0,8-3,8 % |
Některá data mohou pocházet z datové položky. | |
Izoforon je α,β-nenasycený keton, bezbarvá až nažloutlá kapalina s vůní připomínající mátu. Používá se jako rozpouštědlo a jako surovina v organické syntéze.
Reaktivita
Izoforon může být degradován reakcí s hydroxylovými radikály vytvořenými fotochemicky. Poločas této reakce je kolem pěti hodin.[2]
Tato látka reaguje se silnými oxidačními činidly, silnými zásadami a aminy.
Výroba
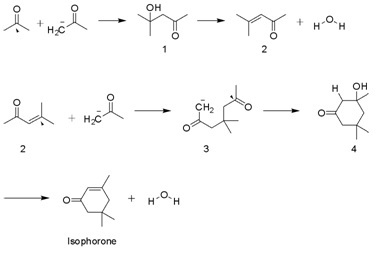
Izoforon se v přírodě nevyskytuje, na jeho výrobu bylo vyvinuto několik postupů. Nejčastěji používaná metoda zahrnuje autokondenzaci acetonu s KOH. Dehydrogenovaný aceton umožňuje uhlíkovým atomům na jedné molekule atakovat centrální (tedy karbonylový) uhlík druhé molekuly acetonu. Při této reakci vzniká diacetonalkohol (4-hydroxy-4-methylpentan-2-on)(1), jeho dehydratací se tvoří mesityloxid(2) a voda jako vedlejší produkt. Dehydrogenovaný aceton poté může dále v Michaelově reakci reagovat s mesityloxidem na 4,4-dimethyl-2,6-dioxoheptan-1-id (3), který atakuje vlastní karbonylový uhlík za vzniku 3-hydroxy-3,5,5-trimethylcyclohexan-1-onu (4). Dehydratací tohoto produktu se nakonec utvoří izoforon.
Jako katalyzátor se, má-li být vzniklý izoforon v kapalném skupenství, většinou používá jako katalyzátor smíšený oxid Mg1-xAlxO1+x. Pro syntézu izoforonu ve formě par je potřeba, aby autokondenzace acetonu proběhla při teplotě vyšší než 200 °C.[3]
Použití
Izoforon se používá jako rozpouštědlo v některých tiskařských inkoustech, barvách, lacích, lepidlech, kopolymerech, nátěrech a pesticidech[4], také jako meziprodukt v organické syntéze, složka podlahových tmelů a přípravků na konzervaci dřeva.
Historie
Používání izoforonu jako rozpouštědla vyplynulo z výzkumu způsobů, jak likvidovat nebo recyklovat aceton, který je odpadním produktem při syntéze fenolu přes kumen.[5]
Izomery

Hlavním vedlejším produktem při vzniku izoforomu (někdy zvaného α-izoforon) je β-izoforon (3,5,5-trimethylcyclohex-3-en-1-on).
Metabolismus
Izoforonu se lze vystavit třemi způsoby: vdechnutím, vstřebáním kůží a vypitím vody, která obsahuje tuto látku.
Těmito třemi způsoby může izoforon proniknout epitelovými tkáněmi, poté se stává toxickým.
Izoforon je dobře absorbován a je rozpustný ve vodě.[6] Díky tomu jej nejpravděpodobněji lze nalézt v moči. Tyto údaje byly získány ze studií na krysách.
Téměř 93 % izoforonu, který se do těla dostane ústní dutinou, je během 24 hodin vyloučeno v nezměněné podobě, převážně močí a vydechovaným vzduchem. Distribuce izoforonu v organismu byla měřena pomocí radioaktivního značkování 14C, izotopu, který je dobře přijímán všemi tkáněmi. Nejvyšší koncentrace po 24 hodinách byly nalezeny v játrech, ledvinách a v předkožkových žlázách.[7]
Moč také obsahovala tyto deriváty izoforonu:
- 3-karboxy-5[ujasnit] (vzniká methyloxidací)
- 5-dimethyl-2-cyklohexen-1-on (methyloxidace)
Toxicita
Dobrovolníci, kteří bylo vystaveni izoforonu o koncentracích 40, 80, 200 a 400 ppm pocítili dráždění v nosu, krku a na očích. Lidské oči jsou drážděny už při koncentraci 25 ppm. Silnější dráždění očí a nosu nastalo při 200 až 400 ppm.
Při dlouhodobém vystavení
Dlouhodobé vystavení izoforonu způsobuje nevolnost, únavu a depresi. Studie na zvířatech ukázaly, že dlouhodobé vdechování izoforonu ovlivňuje centrální nervovou soustavu. Minimální jsou důkazy o vadách a zpomalení růstu plodu při expozici izoforonu v průběhu těhotenství. Informace o případné reprodukční či vývojové toxicitě nebo karcinogenitě izoforonu nejsou k dispozici.
Dle studie na USA a Švédsku vyšší hladiny isoforonu ve vzduchu vedou k více narozeným synům oproti dcerám[8].
Reference
V tomto článku byl použit překlad textu z článku Isophorone na anglické Wikipedii.
- ↑ a b Isophorone. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ TOXNET [online]. [cit. 2016-03-11]. Dostupné online.
- ↑ TEISSIER, Remy; KERVENNAL, Jacques. Process for obtaining isophorone. [s.l.]: [s.n.], 15 Dec 1998. Dostupné online.
- ↑ Chronic Toxicity Summary. www.oehha.ca.gov [online]. [cit. 2017-10-23]. Dostupné v archivu pořízeném dne 2006-09-22.
- ↑ Isophorone history at Degussa
- ↑ QUINCY. National Fire Protection Association [online]. [cit. 2017-10-23]. Dostupné v archivu pořízeném dne 2017-07-13.
- ↑ ISOPHORONE - National Library of Medicine HSDB Database [online]. [cit. 2016-03-11]. Dostupné online.
- ↑ LONG, Yanan; CHEN, Qi; LARSSON, Henrik. Observable variations in human sex ratio at birth. PLOS Computational Biology. 2. 12. 2021, roč. 17, čís. 12, s. e1009586. Dostupné online [cit. 2021-12-03]. ISSN 1553-7358. DOI 10.1371/journal.pcbi.1009586. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Izoforon na Wikimedia Commons
Obrázky, zvuky či videa k tématu Izoforon na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
chemical structure of isophorone
Autor: Toxgroup, Licence: CC BY-SA 4.0
A self-condensation of acetone is depicted here eventually leading to the synthesis of isophorone