Jodid stříbrný
| Jodid stříbrný | |
|---|---|
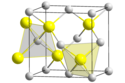
 Model krystalové mřížky AgI | |
 Vzhled jodidu stříbrného | |
| Obecné | |
| Systematický název | Jodid stříbrný |
| Latinský název | argenti iodidum argentum iodatum |
| Anglický název | Silver iodide |
| Německý název | Silberiodid |
| Sumární vzorec | AgI |
| Vzhled | žlutá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 7783-96-2 |
| Vlastnosti | |
| Molární hmotnost | 234,771 g/mol |
| Teplota tání | 554 °C |
| Teplota varu | 1 506 °C |
| Teplota změny krystalové modifikace | 136 °C (γ → β) 147 °C (β → α) |
| Hustota | 5,674 g/cm3 (γ) 5,64 g/cm3 (β) 6,1 g/cm3 (α) |
| Index lomu | modifikace γ nDa= 2,21 nDc= 2,22 |
| Rozpustnost ve vodě | 2,8×10−7 g/100 g |
| Rozpustnost v polárních rozpouštědlech | roztok jodidu draselného roztoky thisíranů roztoky kyanidů roztok amonné soli (málo) |
| Součin rozpustnosti | 8,32×10−17 (γ) |
| Měrná magnetická susceptibilita | −4,6510−6 cm3 g−1 (19 °C, γ) |
| Struktura | |
| Krystalová struktura | krychlová plošně centrovaná (γ) šesterečná (β) krychlová tělesově centrovaná (α) |
| Hrana krystalové mřížky | modifikace γ a= 648,9 pm modifikace β a= 459,24 pm c= 751,04 pm modifikace α a= 670,7 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −61,9 kJ/mol (γ) |
| Entalpie tání ΔHt | 40,1 J/g |
| Entalpie rozpouštění ΔHrozp | 478,3 J/g |
| Standardní molární entropie S° | 155,5 JK−1mol−1 (γ) |
| Standardní slučovací Gibbsova energie ΔGf° | −66,4 kJ/mol (γ) |
| Izobarické měrné teplo cp | 0,243 JK−1g−1 (γ) |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | žádné nejsou |
| S-věty | S22, S24/25 |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Jodid stříbrný je anorganická sloučenina jodu a stříbra s chemickým vzorcem AgI. Obsahuje stříbrné kationty (Ag+) a jodidové anionty (I−), je to tedy iontová sloučenina. Za standardních podmínek je to pevná nažloutlá sůl. Je prakticky nerozpustná ve vodě a velmi špatně rozpustná v koncentrovaném roztoku amoniaku[2] nebo thiosíranu sodném, což se používá k důkazu jodidových iontů v analytické chemii.
Přirozeně se vyskytuje jako poměrně vzácný minerál jodargyrit asi na 135 místech na světě. Nachází se v ložiscích bohatých na stříbro spolu s dalšími sekundárními minerály stříbra, jako je akantit, bromargyrit a chlorargyrit.
Pro svou citlivost na světlo se používal ve fotografii a pro své desinfekční účinky jako antiseptikum v medicíně. Krystalická struktura β-AgI je podobná struktuře ledu a používá se proto k umělému vyvolávání deště a zakládání oblaků.
Struktura
Krystalová struktura jodidu stříbrného se s teplotou mění. Jsou známy následující fáze[3]:
- Do teploty 420 K (147 °C) existuje AgI v β fázi, což je wurtzitová struktura. Je znám jako minerál jodargyrit.
- Nad 420 K podléhá AgI přeměně na α fázi, což je objemově centrovaná krychlová struktura a stříbrné ionty jsou náhodně rozptýleny mezi koordinační čísla 2, 3 a 4.
- Při teplotách pod 420 K existuje i metastabilní γ fáze mající sfaleritickou strukturu. V přírodě se této podobě vyskytuje v podobě minerálu miersitu.
Příprava
Jodid stříbrný se získává srážením z roztoku dusičnanu stříbrného pomocí jodidu draselného:
AgNO3 + KI → AgI↓ + KNO3
Tato reakce se také používá v chemické analýze pro detekci jodidových iontů, protože AgI tvoří špatně rozpustnou nažloutlou sraženinu.
Jodid stříbrný není rozpustný v amoniaku a thiosíranu sodném, a proto jej lze odlišit od chloridu stříbrného (AgCl) a bromidu stříbrného (AgBr), které lze rozpustit v těchto látkách za tvorby komplexů. Rozpouští se pouze v silných chelatačních činidlech (organické sloučeniny vázající se na kovové kationty) jako jsou například kyanidy nebo thiokyanatany.
Jodid stříbrný je citlivý na světlo a pomalu se za jeho působení rozkládá na své prvky. Při vystavení slunečnímu záření mění barvu na zelenošedou.
Použití
Fotografie

V 19. století v počátcích fotografie se jodid stříbrný, kvůli své citlivosti na světlo, používal pro různé tiskové procesy, jako je daguerrotypie, kalotypie nebo argyrotypie. Později byl nahrazen vhodnějšími látkami, jako je například bromid stříbrný.
Již v roce 1839 si nechal francouzský malíř a průkopník fotografie Louis Daguerre patentovat proces, při kterém se fotografický obraz zaznamenával na desku potaženou jodidem stříbrným. Doba expozice trvala asi 15 až 20 minut na rozdíl od dřívějších mnohahodinových expozic. Tento proces byl po něm nazván daguerrotypie. Skládal se ze tří kroků:
- Osvětlení média citlivého na světlo - jodidu stříbrnému
- Vyvolání latentního obrazu - parami rtuti
- Ustálení obrazu – nejprve pomocí chloridu sodného, později thiosíranu sodného.

V roce 1841 si nechal britský vynálezce William Fox Talbot patentovat proces, který nazval kalotypie (calotypie nebo argyrotypie). Název odvodil z řeckých slov κάλο (dobrý) a τύπος (obraz). Výhody procesu spočívaly ve snímání na papír, výrobu pozitivu z negativu a neomezeném kopírování. Problémem byla nepravidelná struktura papírových vláken, která se přenášela i na fotografie. Použití své metody reguloval přísnými pravidly, což zabránilo jejímu většímu rozšíření.
Vyvolání deště

Krystalová struktura jodidu stříbrného (β-AgI) je podobná struktuře ledu a jeho krystalky tak mohou působit jako kondenzační jádra. To umožňuje vyvolat mrznutí vody (heterogenní nukleaci) při zakládání oblaků za účelem umělého vyvolání deště. Na jeden takový experiment je třeba asi 10 až 50 gramů. V současnosti se ročně za tímto účelem spotřebuje zhruba 50 tun jodidu stříbrného.
- Již ve 40. a 50. letech 20. století byly v USA učiněny pokusy předčasně zmírnit hurikány jodidem stříbrným. Účinek byl však omezený.
- V roce 1958 byl v Německu zřízen organizovaný systém obrany proti krupobití, který raketami vystřeloval jodid stříbrný z více než 100 odpalovacích míst do mraků. Podobné systémy byly používány také v Rakousku a Švýcarsku.
- Od 80. let 20. století byly prováděny pokusy cíleným způsobem zásobovat určité oblasti srážkami očkováním mraků částicemi jodidu stříbrného. Účinnost této metody byla opět velmi nízká (asi o 10 % více srážek).
- V současnosti používají některé země jodid stříbrný k vyvolání předčasného deště, aby udrželi určitou oblast bez deště v daném termínu. V Moskvě se například snaží, aby bylo slunečno ve dnech oslav 9. května (Den vítězství) a 12. června (Den Ruska). V roce 2008 na Letních olympijských hrách v Pekingu byl jodid stříbrný zaveden do dešťových mraků pomocí raket, aby zahajovací ceremoniál proběhl bez deště.
- Dodnes se tato metoda nejvíce používá v Číně nebo na Blízkém východě, například ve Spojených arabských emirátech.
Iontový vodič

Jodid stříbrný (především jeho stabilní forma α-AgI) je díky své vysoké elektrické vodivosti iontů stříbra dobrým vodičem pevných iontů. Jeho iontová vodivost se pohybuje v řádu 1 až 2 Siemens/cm a je srovnatelná s kapalnými elektrolyty.
Vysvětlení vodivosti jodidu stříbrného lze nalézt ve změnách jeho forem. Krystalová mřížka AgI je při přeměně mezi formami α a β částečně roztavená. Entropie tání pro α-AgI je přibližně poloviční oproti entropii chloridu sodného - typická iontová tuhá látka. Forma α-AgI má krychlovou uvnitř centrovanou podmřížku aniontů jodu a strukturálně neuspořádanou podmřížku kationtů stříbra. Ionty stříbra se proto mohou volně pohybovat mezi většími jodidovými ionty. Začleněním iontů rubidia do jodidu stříbrného (Ag4RbI5) lze teplotu fázového přechodu α/β snížit pod pokojovou teplotu. Díky tomu je jodid stříbrný zvláště vhodný jako pevný elektrolyt.
Odkazy
Reference
V tomto článku byly použity překlady textů z článků Silberiodid na německé Wikipedii a Silver iodide na anglické Wikipedii.
- ↑ a b Silver Iodide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Stříbro - Remy H.: Anorganická chemie II.. www.eurochem.cz [online]. [cit. 2009-08-14]. Dostupné v archivu pořízeném z originálu dne 2015-04-02.
- ↑ BINNER, J. G. P., Dimitrakis, G.; Price, D. M.; Reading, M.; Vaidhyanathan, B. Hysteresis in the β–α Phase Transition in Silver Iodide. Journal of Thermal Analysis and Calorimetry. 2006, roč. 84, s. 409–412. Dostupné online [PDF]. DOI 10.1007/s10973-005-7154-1.
Související články
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu jodid stříbrný na Wikimedia Commons
Obrázky, zvuky či videa k tématu jodid stříbrný na Wikimedia Commons - A commercial site (Vista Chemicals) regarding silver iodide
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Daguerrotipo
Crystal structure of ZnS (sphalerite) with coordination polyhedra
Autor: Christian Jansky (User:Tschaensky), Licence: CC BY-SA 2.5
Cessna 206, rebuilt for cloud seeding, with detail view of silver iodide generator
"The Footman", the earliest photograph of a human figure on paper by William Henry Fox Talbot.