Jodmethan
| Jodmethan | |
|---|---|
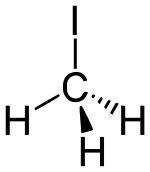 Strukturní vzorec | |
 Tyčinkovo-kuličkový model molekuly | |
 Kalotový model molekuly | |
| Obecné | |
| Systematický název | jodmethan |
| Ostatní názvy | monojodmethan, methyljodid |
| Anglický název | Iodomethane |
| Německý název | Iodmethan |
| Sumární vzorec | CH3I |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 74-88-4 |
| EC-no (EINECS/ELINCS/NLP) | 200-819-5 |
| PubChem | 6328 |
| ChEBI | 39282 |
| UN kód | 2644 |
| SMILES | CI |
| InChI | 1/CH3I/c1-2/h1H3 |
| Číslo RTECS | PA9450000 |
| Vlastnosti | |
| Molární hmotnost | 141,939 g/mol |
| Teplota tání | −66,5 °C (206,6 K) |
| Teplota varu | 42,4 až 42,8 °C (315,6 až 316,0 K) |
| Hustota | 2,28 g/cm3 |
| Index lomu | 1,530 až 1,531 |
| Rozpustnost ve vodě | 1,4 g/100 ml (20 °C) |
| Tlak páry | 54,4 kPa (20 °C) |
| Měrná magnetická susceptibilita | −4,03×105 μm3/g |
| Struktura | |
| Tvar molekuly | čtyřstěnný |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −14,1 až −13,1 kJ/mol |
| Standardní molární spalná entalpie ΔH°sp | −808,9 až −808,3 kJ/mol |
| Měrné teplo | 82,75 J⋅K−1⋅mol−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H301 H312 H315 H331 H335 H351 |
| P-věty | P261 P280 P301+310 P311 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Jodmethan (též methyljodid nebo monojodmethan, zkratkou MeI) je organická sloučenina se vzorcem CH3I. Patří mezi halogenderiváty uhlovodíků, jeho molekula vychází z molekuly methanu, kde je jeden atom vodíku nahrazen atomem jodu. Za běžných podmínek má jodmethan podobu husté bezbarvé těkavé kapaliny mísitelné s organickými rozpouštědly. V malém množství vzniká přirozeně v rostlinách rýže.[2] Využívá se v organické syntéze k methylaci. Kontroverzním rozhodnutím EPA v roce 2007 byl také schválen jako pesticid.[3]
Vlastnosti
Jodmethan je bezbarvá kapalina, relativně těkavá (teplota varu 41–43 °C). Rozpouští se v mnoha organických rozpouštědlech. Podobně jako mnoho jiných organojodidových sloučenin je potřeba ho uchovávat ve tmavých láhvích, protože se na světle rozkládá; uvolňovaný jod barví kapalinu purpurově. Komerční produkty mohou být stabilizovány měděným nebo stříbrným drátem.[4]
Reference
V tomto článku byl použit překlad textu z článku Methyl iodide na anglické Wikipedii.
- ↑ a b Iodomethane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ K. R. Redeker, N.-Y. Wang, J. C. Low, A. McMillan, S. C. Tyler, and R. J. Cicerone. Emissions of Methyl Halides and Methane from Rice Paddies. Science. 2000, s. 966–969. DOI 10.1126/science.290.5493.966. PMID 11062125. (anglicky)
- ↑ Zitto, Kelly Methyl iodide gains state OK for use on crops. San Francisco Chronicle. December 2, 2010. Dostupné online. (anglicky)
- ↑ SULIKOWSKI, Gary A.; SULIKOWSKI, Michelle M.; HAUKAAS, Michael H.; MOON, Bongjin. e-EROS. Iodomethane. [s.l.]: [s.n.], 2005. DOI 10.1002/047084289X.ri029m.pub2. (anglicky)
Literatura
- Sulikowski, G. A.; Sulikowski, M. M. (1999). in Coates, R.M.; Denmark, S. E. (Eds.) Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation New York: Wiley, pp. 423–26.
- Bolt H. M., Gansewendt B. Mechanisms of carcinogenicity of methyl halides.. Crit Rev Toxicol.. 1993, s. 237–53. DOI 10.3109/10408449309105011. PMID 8260067. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Jodmethan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Jodmethan na Wikimedia Commons - IARC Summaries & Evaluations: Vol. 15 (1977), Vol. 41 (1986), Vol. 71 (1999)
- Metabolism of iodomethane in the rat
- Iodomethane NMR spectra
- JONES, Nicola. Strawberry pesticide leaves sour taste: Methyl iodide use by Californian farmers up for review.. Nature News. September 24, 2009. Dostupné online [cit. September 25, 2009]. (anglicky)
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
methyl iodide; iodomethane