Jonesova oxidace
Jonesova oxidace je organická reakce spočívající v oxidaci primárních alkoholů na karboxylové kyseliny a sekundárních na ketony. Šlo o jednu z prvních metod oxidace alkoholů, která byla nahrazena postupy založenými na mírnějších podmínkách a selektivních činidlech, jako je Collinsovo.[1]
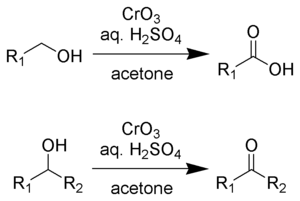
Jako Jonesovo činidlo se označuje roztok oxidu chromového v kyselině sírové. Tento roztok se přidává k acetonovému roztoku substrátu. Místo oxidu chromového lze použít i dichroman draselný. Oxidace probíhá velmi rychle a je silně exotermní.
Výtěžnosti bývají vysoké a činidlo je snadno dostupné; chromové sloučeniny jsou ale karcinogenní, což způsobuje omezení využívání tohoto postupu.
Stechiometrie a mechanismus
Jonesovo činidlo přeměňuje primární alkoholy na aldehydy a sekundární na ketony. Za určitých reakčních podmínek mohou být aldehydy dále přeměněny na karboxylové kyseliny. Při oxidacích aldehydů a ketonů oxidují dva ekvivalenty kyseliny chromové tři ekvivalenty alkoholu:
- 2 HCrO4− + 3 RR'C(OH)H + 8 H+ + 4 H2O → 2 [Cr(H2O)6]3+ + 3 RR'CO
U oxidací primárních alkoholů na karboxylové kyseliny 4 ekvivalenty kyseliny oxidují tři ekvivalenty alkoholu, přičemž se jako meziprodukt tvoří aldehyd.
- 4 HCrO4− + 3 RCH2OH + 16 H+ + 11 H2O → 4 [Cr(H2O)6]3+ + 3 RCOOH
Anorganické produkty jsou zbarvené zeleně, jak je běžné u chromitých aquakomplexů.[2]
Podobně jako mnohé jiné oxidace alkoholů kovovými oxidy probíhá reakce přes smíšený chromátový ester, CrO3(OCH2R)−.[3][4]
- CrO3(OH)− + RCH2OH → CrO3(OCH2R)− + H2O
Podobně jako u běžných esterů tvorbu těchto chromátů urychluje přítomnost kyseliny. Tyto estery lze izolovat, pokud je příslušný alkohol terciární, protože takové alkoholy nemají α vodíky, které by se odštěpily za vzniku karbonylové sloučeniny. Pomocí terc-butylalkoholu je například možné izolovat di-terc-butylchromát ((CH3)3CO)2CrO2), který je také dobrým oxidačním činidlem.[5]
Alkoholy obsahující atomy vodíku v poloze alfa vůči kyslíku vedou k rozpadu chromátu na karbonylovou sloučeninu a špatně popsatelný chromičitý produkt:
- CrO3(OCH2R)− → CrO2OH− + O=CHR
Deuterované alkoholy HOCD2R se oxidují přibližně šestkrát pomaleji než jejich nedeuterované obdoby. Tento výrazný kinetický izotopový efekt naznačuje, že krokem určujícím rychlost reakce je štěpení vazeb C–H (nebo C–D).

Stechiometrie reakce naznačuje, že se vytváří chromičitý meziprodukt CrO2OH−, který se synproporcionuje s kyselinou chromovou na oxid chromičný, také vyvolávající oxidaci alkoholu.[6]
Oxidace aldehydů pravděpodobně procházejí přes poloacetalové meziprodukty, vznikající navazováním O3CrO-H− na vazby C=O.
K oxidacím násobných vazeb dochází výjimečně.
Příklady reakcí
Jonesova oxidace se stále používá v organické syntéze.[2][7] Ke sledování průběhu reakce lze použít například infračervenou spektroskopii.
Podobné postupy
K oxidaci alkoholů lze také použít Collinsovo činidlo, dichroman pyridinia a chlorchroman pyridinia.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Jones oxidation na anglické Wikipedii.
- ↑ Oxidation of Alcohols to Aldehydes and Ketones. [s.l.]: [s.n.], 2006. ISBN 0-387-23607-4. DOI 10.1007/0-387-25725-X_1. Kapitola Chromium-based Reagents, s. 1–95.
- ↑ a b EISENBRAUN, E. J. Cyclooctanone. Org. Synth.. 1965, s. 28. DOI 10.15227/orgsyn.045.0028. (anglicky)
- ↑ SMITH, Michael, October 17-. March's advanced organic chemistry : reactions, mechanisms, and structure.. 6th ed.. vyd. Hoboken, N.J.: Wiley-Interscience, 2007. xx, 2357 pages s. Dostupné online. ISBN 0-471-72091-7, ISBN 978-0-471-72091-1.
- ↑ S. V. Ley; A. Madin. Comprehensive organic synthesis. Oxford: Pergamon Press, 1991. S. 253–256.
- ↑ Fillmore Freeman, "Di-tert-butyl Chromate" Encyclopedia of Reagents for Organic Synthesis, 2001, John Wiley & Sons, Ltd. DOI:10.1002/047084289X.rd059m
- ↑ Oxidation in Organic Chemistry. Edited by K. B. Wiberg, Academic Press, NY, 1965
- ↑ MEINWALD, J.; CRANDALL, J.; HYMANS, W. E. Nortricyclanone. Org. Synth.. 1965, s. 77. DOI 10.15227/orgsyn.045.0077. (anglicky)
Literatura
- Bowden, K.; HEILBRON, I. M.; JONES, E. R. H. 13. Researches on acetylenic compounds. Part I. The preparation of acetylenic ketones by oxidation of acetylenic carbinols and glycols. Journal of the Chemical Society. 1946, s. 39. DOI 10.1039/jr9460000039. (anglicky)
- Heilbron, I. M.; JONES, E. R. H.; SONDHEIMER, F. 129. Researches on acetylenic compounds. Part XV. The oxidation of primary acetylenic carbinols and glycols. Journal of the Chemical Society. 1949, s. 604. DOI 10.1039/jr9490000604. (anglicky)
- Bladon, P.; FABIAN, Joyce M.; HENBEST, H. B.; KOCH, H. P.; WOOD, Geoffrey W. 532. Studies in the sterol group. Part LII. Infra-red absorption of nuclear tri- and tetra-substituted ethylenic centres. Journal of the Chemical Society. 1951, s. 2402. DOI 10.1039/jr9510002402. (anglicky)
- Jones, E. R. H. 92. The chemistry of the triterpenes. Part XIII. The further characterisation of polyporenic acid A. Journal of the Chemical Society. 1953, s. 457. DOI 10.1039/jr9530000457. (anglicky)
- Jones, E. R. H. 520. The chemistry of the triterpenes and related compounds. Part XVIII. Elucidation of the structure of polyporenic acid C. Journal of the Chemical Society. 1953, s. 2548. DOI 10.1039/jr9530002548. (anglicky)
- Jones, E. R. H. 599. The chemistry of the triterpenes and related compounds. Part XIX. Further evidence concerning the structure of polyporenic acid A. Journal of the Chemical Society. 1953, s. 3019. DOI 10.1039/jr9530003019. (anglicky)
- C. Djerassi, R. Engle and A. Bowers. Notes – The Direct Conversion of Steroidal Δ5-3β-Alcohols to Δ5- and Δ4-3-Ketones. The Journal of Organic Chemistry. 1956, s. 1547–1549. DOI 10.1021/jo01118a627. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Jonesova oxidace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Jonesova oxidace na Wikimedia Commons
Média použitá na této stránce
Autor: Emanresucamit, Licence: CC BY-SA 4.0
Curly arrows mechanism for Jones oxidation of secondary alcohols. The oxidation depends on the presence of the blue-colored hydrogen atom. Because the blue H-atom is absent in tertiary alcohols, they're inert towards oxidation. The primary alcohols oxidize to aldehydes, which later convert to hydrate forms, which undergo the second round of Jones Oxidation.
Description: Reaction scheme of the Jones oxidation.
- Author, date of creation: selfmade by ~K, 27 November 2005.
- Source: -
- Copyright: Public domain. (PD)
- Comments: high-resolution b/w PNG; ChemDraw / The GIMP.

