Karbodiimid

Karbodiimid (systematický název methandiimin[1]) je název funkční skupiny s obecným vzorcem RN=C=NR. Látky obsahující tuto skupinu jsou výhradně umělého původu, v přírodě nebyly nalezeny. Příkladem je dicyklohexylkarbodiimid, používaný při syntéze peptidů.[2] Dialkylkarbodiimidy jsou stabilní. Některé diraylkarbodiimidy vytvářejí za pokojové teploty dimery a polymery, což se nejčastěji děje u karbodiimidů s nízkou teplotou tání, které jsou za běžných podmínek kapalné.[3] Pevné diarylkarbodiimidy jsou stabilnější, ale za přítomnosti vody mohou pomalu podléhat hydrolýze.
Struktura
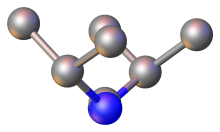
Z hlediska vazeb jsou karbodiimidy isoelektronické s oxidem uhličitým. Vytvářejí celkem třirezonanční struktury:
- RN=C=NR ↔ RN+≡C-N−R ↔ RN−-C≡N+R
N=C=N jádra jsou téměř lineární, úhel vazby N=C=N je 170° a úhly vazeb C-N=C bývají 126±1°.[4] Délky vazeb C=N jsou okolo 120 pm. Karbodiimidy jsou chirální, mají C2-symetrii.[5] V důsledku nízké energetické bariéry pro rotaci molekul dochází k rychlým přeměnám na příslušné izomery, kvůli čemuž je izolace jednoho konkrétního enantiomeru karbodiimidu velmi obtížná; byla popsána příprava jednotlivých izomerů některých karbodiimidů, ovšem o její důvěryhodnosti se pochybuje.[6][7]
Výchozí sloučenina methandiimin (HN=C=NH) je tautomerem kyanamidu.
Příprava
Z derivátů močoviny a thiomočoviny
Obvyklým způsobem přípravy karbodiimidů je dehydrosulfurizace derivátů thiomočoviny pomocí oxidu rtuťnatého.[8]
- (R(H)N)2CS + HgO → (RN)2C + HgS + H2O
Karbodiimidy lze také získat dehydratací N,N'-dialkylmočovin:
- (R(H)N)2CO → (RN)2C + H2O
Jako dehydratační činidlo se používá oxid fosforečný[9] nebo p-toluensulfonylchlorid[10][11]
Z izokyanátů
Izokyanáty mohou být přeměněny na karbodiimidy za odštěpení oxidu uhličitého.[12][3]
- 2 RN=C=O → (RN)2C + CO2
Tato reakce je vratná; katalyzují ji fosfinoxidy.
Reakce
Ve srovnání s ostatními heteroalleny jsou karbodiimidy slabými elektrofily a s nukleofily reagují pouze za přítomnosti katalyzátorů, jako jsou kyseliny.[13] Tímto způsobem lze například připravit guanidin.[2] Jako slabé zásady se karbodiimidy vážou na Lewisovy kyseliny.
Moffattova oxidace
Karbodiimidy mohou vstupovat do Moffatových oxidací, při kterých se mění alkoholy na karbonylové sloučeniny za použití dimethylsulfoxidu jako oxidačního činidla.[14]
- (CH3)2SO + (CyN)2C + R2CHOH → (CH3)2S + (CyNH)2CO + R2C=O
Sulfoxid a diimid se obvykle používají v přebytku.[15]
Tvorba amidů
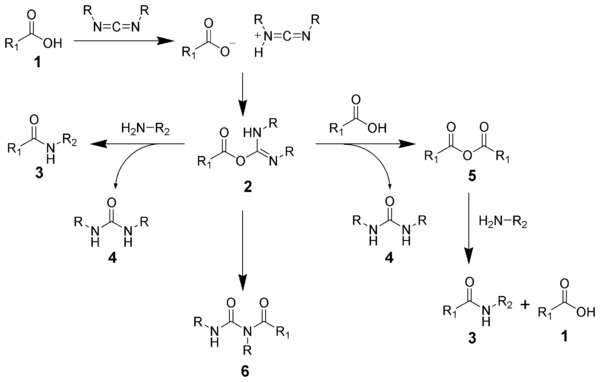
Při přípravě amidů z karbodiimidů dochází k vedlejším reakcím. Kyselina 1 reaguje s karbodiimidem za vzniku O-acylisomočoviny 2, což je v podstatě ester karboxylové kyseliny s aktivovanou odstupující skupinou. O-acylisomočovina následně reaguje s aminy, čímž se vytváří amid 3 a močovina 4.
O-acylisomočovina 2 může reagovat s dalším ekvivalentem karboxylové kyseliny 1 za tvorby acylanhydridu 5, který se může přeměnit na amid 3. Častou vedlejší reakcí je přeměna O-acylisomočoviny na nereaktivní N-acylmočovinu 6. Použitím rozpouštědel s nízkou relativní permitivitou, jako jsou dichlormethan a chloroform, lze tyto vedlejší reakce omezit.[16]
Ostatní reakce
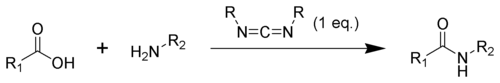
Sloučeniny obsahující karbodiimidové skupiny se používají v organické syntéze jako dehydratační činidla, nejčastěji při přeměně karboxylových kyselin na amidy a estery. Za účelem zvýšení výtěžnosti a omezení vedlejších reakcí se někdy do reakční směsi přidávají další látky, jako jsou například N nebo N.
Polykarbodiimidy je nožné použít jako zesíťovací činidla u některých pryskyřic, jako jsou polyuretany a polyakryláty. Polykarbodiimid zde reaguje s karboxylovými skupinami, které jsou v takových pryskyřicích časté, za tvorby N-acylmočoviny. Tato reakce vede ke vzniku kovalentních vazeb mezi molekulami polymeru a vzniku síťovité struktury.[17][18]
Příklady
Dicyklohexylkarbodiimid

Dicyklohexylkarbodiimid (DCC) je jedním z prvních karbodiimidů používaných v chemických reakcích. Používá se na přípravů amidů a esterů, například při syntéze peptidů. K jeho výhodám patří vysoké výtěžnosti reakcí sloužících k přípravě amidů. Nevýhodami jsou tvorba N,N'-dicyklohexylmočoviny jako vedlejšího produktu, který lze odstranit filtrací, ovšem stopová množství nečistot se odstraňují obtížně. Navíc je DCC silný alergen.
Diisopropylkarbodiimid

Isopropylkarbodiimid (DIC) je kapalina, jejíž hydrolýzou vzniká N,N'-diisopropylmočovina, rozpustná v organických rozpouštědlech.
EDC
1-ethyl-3-(3-dimethylaminopropyl)karbodiimid (EDC) má široké možnosti využití; kromě těch uvedených u DCC a DIC jde například o to, že může být použit jako zesíťovací činidlo v biochemii.
Reference
V tomto článku byl použit překlad textu z článku Carbodiimide na anglické Wikipedii.
- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry, 2014. ISBN 978-0-85404-182-4. DOI 10.1039/9781849733069-00372. S. 375.
- ↑ a b Andrew Williams; Ibrahim T. Ibrahim. Carbodiimide Chemistry: recent Advances. Chemical Reviews. 1981, s. 589–636. DOI 10.1021/cr00046a004.
- ↑ a b T. W. Campbell; J. J. Monagle. Diphenylcarbodiimide. Organic Syntheses. 1963, s. 31. DOI 10.15227/orgsyn.043.0031.
- ↑ a b H. Irngartinger; H.-U. Jäger. Kristall- und Molekularstrukturen von zwei Carbodiimiden: Bis(diphenylmethyl)carbodiimid und Bis(p-methoxyphenyl)-carbodiimid. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 1978, s. 3262–3265. DOI 10.1107/S0567740878010626.
- ↑ A. T. Vincent; P. J. Wheatley. Crystal Structure of Bis-p-nitrophenylcarbodiimide, O2N·C6H4·N:C:N·C6H4·NO2. Journal of the Chemical Society, Perkin Transactions. 1972, s. 1567–1571. DOI 10.1039/P29720001567.
- ↑ Tohru Taniguchi; Takahiro Suzuki; Haruka Satoh; Yukatsu Shichibu; Katsuaki Konishi; Kenji Monde. Preparation of Carbodiimides with One-Handed Axial Chirality. Journal of the American Chemical Society. 2018, s. 15 577 – 15 581. Dostupné online [cit. 2020-08-18]. DOI 10.1021/jacs.8b08969.
- ↑ Robert Damrauer; Hai Lin; Niels H. Damrauer. Computational Studies of Carbodiimide Rings. Journal of Organic Chemistry. 2014, s. 3781–3788. Dostupné online [cit. 2020-08-18]. DOI 10.1021/jo4026435.
- ↑ Frederick Kurzer; K. Douraghi-Zadeh. Advances in the Chemistry of Carbodiimides. Chemical Reviews. 1967, s. 107–152. DOI 10.1021/cr60246a001.
- ↑ Henri Ulrich. Chemistry and Technology of Carbodiimides. [s.l.]: Wiley-VCH, 2008. ISBN 978-0-470-06510-5.
- ↑ John C. Sheehan; Philip A. Cruickshank. 1-Ethyl-3-(3-Dimethylamino)propylcarbodiimide Hydrochloride and Methiodide. Organic Syntheses. 1968, s. 83. DOI 10.15227/orgsyn.048.0083.
- ↑ Arnab K. Maity; Skye Fortier; Leonel Griego; Alejandro J. Metta-Magaña. Synthesis of a "Super Bulky" Guanidinate Possessing an Expandable Coordination Pocket. Inorganic Chemistry. 2014, s. 8155–8164. DOI 10.1021/ic501219q. PMID 25029088.
- ↑ J. J. Monagle. Carbodiimides. III. Conversion of Isocyanates to Carbodiimides. Catalyst Studies. The Journal of Organic Chemistry. 1962, s. 3851–3855. DOI 10.1021/jo01058a022.
- ↑ Zhen Li; Robert J. Mayer; Armin R. Ofial; Herbert Mayr. From Carbodiimides to Carbon Dioxide: Quantification of the Electrophilic Reactivities of Heteroallenes. Journal of the American Chemical Society. 2020-04-27. DOI 10.1021/jacs.0c01960.
- ↑ T. T. Tidwell. Oxidation of Alcohols by Activated Dimethyl Sulfoxide and Related Reactions: An Update. Synthesis. 1990, s. 857–870. DOI 10.1055/s-1990-27036.
- ↑ John G. Moffatt. Cholane-24-al. Organic Syntheses. 1967, s. 25. DOI 10.15227/orgsyn.047.0025.
- ↑ Hotan Mojarradi. Coupling of substances containing a primary amine to hyaluronan via carbodiimide-mediated amidation. [s.l.]: Uppsala Universitet, 2010.
- ↑ L. C. J. Hesselmans; A. J. Derksen; J. A. M. van den Goorbergh. Polycarbodiimide crosslinkers. Progress in Organic Coatings. 2006. ISSN 0300-9440. DOI 10.1016/j.porgcoat.2005.08.011.
- ↑ W. Posthumus; A. J. Derksen; J. A. M. van den Goorbergh; L. C. J. Hesselmans. Crosslinking by polycarbodiimides. Progress in Organic Coatings. 2007. ISSN 0300-9440. DOI 10.1016/j.porgcoat.2006.09.031.
Externí odkazy
 Obrázky, zvuky či videa k tématu Karbodiimid na Wikimedia Commons
Obrázky, zvuky či videa k tématu Karbodiimid na Wikimedia Commons





