Karboximidáty

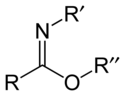
Karboximidáty jsou organické sloučeniny, které lze považovat za estery karboximidových kyselin (R-C(=NR')OH) a alkoholů, jejich obecný vzorec je R-C(=NR')OR".
Tyto sloučeniny bývají také nazývány iminoethery, protože odpovídají iminům (>C=N-) propojeným s uhlíkovým atomem přes atom kyslíku.
Příprava
Imidáty mohou být připraveny několika postupy,[1] nejčastěji se používá Pinnerova reakce, využívající kysele katalyzovaný atak nitrilů alkoholy.

Imidáty připravované tímto způsobem vznikají jako hydrochloridy, někdy nazývané Pinnerovy soli. Takto se tvoří karboximidáty také při Mummově a Overmanově přesmyku.
Imidátové a amidátové anionty
Amidátové a imidátové anionty vznikají deprotonací amidů a imidových kyselin. Protože jsou tyto skupiny sloučenin navzájem tautomerní, tak deprotonací vytvářejí stejné anionty; i označení imidáty a amidáty tak odpovídá stejnému druhu aniontů, i když by se jako imidát měla označovat jedna rezonanční struktura (vlevo) a jako amidát druhá (vpravo). Tyto skupiny se ale rozlišují, pokud slouží jako ligandy přechodných kovů, kde sloučeniny vázané přes atom kyslíku bývají nazývané imidáty a při navázání přes dusík jde o amidáty. V obou případech je lze považovat za azasubstituované analogy enolátů.

Reakce
Karboximidáty jsou dobrými elektrofily a účastní se řady adičních reakcí; alifatické obecně reagují rychleji než aromatické imidáty.[1] Mohou být hydrolyzovány na estery a obdobnými reakcemi s aminy nebo amoniakem vytvářet amidiny. Alifatické imidáty reagují v kyselém prostředí s alkoholy za vzniku orthoesterů (RC(OR)3), aromatické se takovýchto reakcí mohou účastnit také, ovšem reagují výrazně pomaleji.

Chapmanův přesmyk
Chapmanův přesmyk je tepelná přeměna N‐arylbenzimidátů na odpovídající amidy vnitromolekulárním přesunem arylové skupiny z kyslíku na dusík;[3][4] jedná se o reakci podobnou Newmanovu–Kwartovu přesmyku.

Karboximidáty jako chránicí skupiny
Karboximidáty mohou sloužit jako chránicí skupiny pro alkoholy,[5] například zásaditě katalyzovanou reakcí s benzylalkoholem v trichloracetonitrilu se tvoří trichloracetimidát, sloučenina s ortogonální stabilitou díky acetátové a terc-butyldimethylsilylové (TBS) chránicí skupině; tento imidát lze odstranit kyselou hydrolýzou.[6]
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Karboximidáty na Wikimedia Commons
Obrázky, zvuky či videa k tématu Karboximidáty na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Carboximidate na anglické Wikipedii.
- ↑ a b Robert Roger; Douglas G. Neilson. The Chemistry of Imidates. Chemical Reviews. 1961, s. 179–211. DOI 10.1021/cr60210a003.
- ↑ B. P. Mundy, M. G. Ellerd, F. G. Favaloro: Name Reactions and Reagents in organic Synthesis, 2. Auflage, Wiley-Interscience, Hoboken, NJ 2005, ISBN 978-0-471-22854-7, S. 516.
- ↑ J. W. Schulenberg; S. Archer. The Chapman Rearrangement. Organic Reactions. 1965, s. 1–51. ISBN 0471264180. DOI 10.1002/0471264180.or014.01.
- ↑ Arthur William Chapman. CCLXIX.—Imino-aryl ethers. Part III. The molecular rearrangement of N-phenylbenziminophenyl ether. Journal of the Chemical Society. 1925, s. 1992–1998. DOI 10.1039/CT9252701992.
- ↑ Peter G. M. Wuts. Protective groups in organic synthesis. [s.l.]: [s.n.], 2006. ISBN 978-0-471-69754-1. S. 244.
- ↑ Biao Yu; Hai Yu; Yongzheng Hui; Xiuwen Han. Trichloroacetimidate as an Efficient Protective Group for Alcohols. Synlett. 1999, s. 753–755. DOI 10.1055/s-1999-2736.
Média použitá na této stránce
Autor: Kas1989, Licence: CC BY-SA 3.0
grundmechanismus der pinner reaktion
Autor: Kas1989, Licence: CC BY-SA 3.0
Möglichkeiten für die Weiterverarbeitung eines Pinner-Salzes: Carbonsäureester, Orthoester, Iminium-Ionen (von oben nach unten); R1 und R2 bezeichnen Alkylreste
Skeletal formula of a general imidate
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
benzyl_2,2,2-trichloroacetimidate
Resonance structures of a general amidate (amide enolate)