Karboxyláty


Karboxyláty jsou anionty představující konjugované zásady karboxylových kyselin.
Jejich soli se nazývají karboxylátové soli a mají obecný vzorec M(RCOO)n, kde M kation kovu nebo amonný kation a n je 1, 2,...; Karboxylátové estery Mají obecný vzorec RCOOR′ nebo RCO2R′; R a R′ organické skupiny.
Příprava
Karboxylátové ionty se tvoří deprotonací karboxylových kyselin. Tyto kyseliny mají obvykle pKa menší než 5 a mohou být deprotonovány mnoha zásadami, jako jsou hydroxid sodný a hydrogenuhličitan sodný.
Rezonanční stabilizace karboxylátových iontů
Karboxylové kyseliny snadno disociují za tvorby karboxylátových aniontů a kladně nabitých vodíkových iontů (protonů), a to mnohem lépe než alkoholy na alkoxidové ionty a protony), protože karboxylát je rezonančně stabilizován. Záporný náboj vzniklý deprotonací karboxylové skupiny je delokalizován mezi oběma elektronegativními kyslíky a vytváří rezonanční strukturu. Pokud R patří mezi skupiny odtahující elektrony (což je například trifluormethyl (-CF3), tak se zásaditost karboxylátu snižuje a kyselost kyseliny zvyšuje.
V důsledku této delokalizace mají oba atomy kyslíku menší záporné náboje a kladně nabitý proton je tak slaběji vázán ke karboxylové skupině; karboxylátové ionty jsou tak stabilnější a méně zásadité. U alkoxidových iontů mají atomy kyslíku větší náboje a jsou k okolním protonům vázány silněji (alkoxidy jsou tak velmi silnými zásadami). Vzhledem k rezonanční stabilizaci mají karboxylové kyseliny výrazně nižší hodnoty pKa (a jsou tedy silnějšími kyselinami) než alkoholy, například kyselina octová má pKa 4,8, zatímco u ethanolu je jeho hodnota ~16. Kyselina octová je tedy sinější kyselinou a její roztoky mají oproti roztokům ethanolu se stejnou molární koncentrací nižší pH.
Reakce
Nukleofilní substituce
Karboxylátové ionty jsou dobrými nukleofily. Reagují s halogenalkany za vzniku esterů:

Karboxylátové ionty jsou mnohem slabšími nukleofily než hydroxidy a alkoxidy, ovšem silnějšími než halogenidové anionty (v aprotických polárních rozpouštědlech, i když vliv má také například rozpustnost iontu).
Redukce
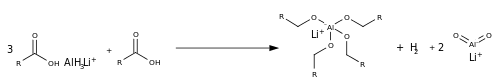
Redukce karboxylátů probíhá jinak než redukce esterů, protože u nich není přítomna odstupující skupina a na uhlíkovém atomu je v důsledku záporného náboje kyslíkových atomů poměrně vysoká elektronová hustota. Kyselinu lze zredukovat hydridem lithno-hlinitým (LAH) přeměnou LAH na Lewisovu kyselinu hydrid hlinitý (AlH3), přičemž se oxyanion mění na čtyři vazby Al-O.
Příklady
- Mravenčanový ion, HCOO−
- Octanový ion, CH3COO−
- Methantetrakarboxylátový ion, C(COO−)4
- šťavelanový ion, (COO) 2−
2
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Carboxylate na anglické Wikipedii.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Karboxyláty na Wikimedia Commons
Obrázky, zvuky či videa k tématu Karboxyláty na Wikimedia Commons
Média použitá na této stránce
Esterification: formation of an ester from a carboxylate and an alkyl bromide. In this example, the acetate ion from sodium acetate reacts with ethyl bromide to form ethyl acetate plus sodium and bromide ions.
Reaction of carboxylic acids reduction - part three
Acrylate-ion molecule model
Reaction of carboxylic acids reduction - part two
Structural description of the delocalisation of electrons in the pi system of a carboxylate anion.