Karcinom žaludku
| Karcinom žaludku | |
|---|---|
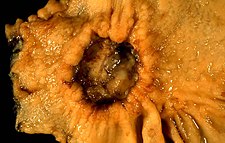 Adenokarcinom žaludku | |
| Klasifikace | |
| MKN-10 | C16 |
| MeSH | D013274 |
| Některá data mohou pocházet z datové položky. | |
Karcinom žaludku je nádorové onemocnění stěny žaludku, které je v současnosti čtvrtou nejčastější příčinou úmrtí na rakovinu v Evropě. Celosvětově je druhým nejčastějším maligním onemocněním. Žaludeční karcinom se vyvíjí složitým mnohastupňovým procesem s několika zřetelnými histologickými a patofyziologickými fázemi. Celý vývoj je ovlivňován komplexem interakcí mezi bakteriemi, prostředím, genetickými dispozicemi hostitele a molekulárními mechanismy. Mnohé z etiologie a patogeneze této choroby zůstává nejasné, avšak základní souvislosti jsou již známy.
V etiologii a patogenezi karcinomu žaludku se uplatňují bakteriální, genetické, imunitní a molekulární faktory. Klíčovým stimulem je zřejmě přítomnost Helicobacter pylori v žaludku. Eradikace H. pylori může nejen zastavit patologické změny stěny žaludku, ale dokonce může dojít ke zvratu atrofie a obnovení normální architektury žaludeční stěny. Vývoj onemocnění probíhá od zánětu přes atrofickou gastritidu, intestinální metaplázii a dysplázii až k adenokarcinomu. Záleží na genetické výbavě bakterie i hostitele, zdali dojde k progresi onemocnění, nebo zda infekce H. pylori bude asymptomatická.
Patologie karcinomu žaludku
Karcinom (přesněji adenokarcinom) žaludku je nejčastější neoplázií žaludeční stěny. V klasifikaci podle Laurena se rozlišují dva typy karcinomů žaludku: difúzní a intestinální.
- Difúzní typ je obvykle spojen s nepříznivou prognózou, neboť často vykazuje silný sklon k invazi do okolní tkáně. Nádorové buňky tohoto typu ztrácejí kohezi a původní funkci. O vzniku tohoto onemocnění je známo poněkud méně.
- Intestinální typ má dobře definované fáze vývoje a nádorové buňky se formují do podoby funkčních žláz gastrointestinálního traktu.
Etiologie a patogeneze karcinomu žaludku
Correova cesta patogeneze
Pelayo Correa ukázal, že patogeneze žaludečního karcinomu intestinálního typu má poměrně zřetelná stádia, která lze prokázat například histologicky. Vývoj směřuje od histologicky zcela normální žaludeční stěny přes akutní zánět, chronický zánět, atrofickou gastritidu, intestinální metaplázii a dysplázii až k adenokarcinomu s případnou metastatickou diseminací.
- Akutní gastritida se projevuje infiltrací mukózy a submukózy lymfocyty, lze pozorovat ložiska polymorfonukleárů doprovázená mírnými slizničními defekty a edémem.
- Chronická gastritida je dlouhodobě aktivní zánět s výraznými slizničními defekty, rozšířením žláz a mineralizací.
- Atrofická gastritida je chronický zánět s ložiskovou fibrózou a kompletní ztrátou parietálních a hlavních buněk.
- Intestinální metaplázie žaludečního epitelu se histologicky projevuje prodloužením buněk a produkcí mucinů.
- Dysplázie je stádium s vysokým stupněm glandulární dysplázie charakterizované nepravidelným tvarem a velikostí, záhyby, větvením a tvorbou pili v epitelu.
- Karcinom žaludku je již intraepiteliální neoplázie s invazí do sliznice.
Role Helicobacter pylori
Infekce žaludečního lumen gramnegativní zahnutou tyčkou Helicobacter pylori je jistě nejdůležitější faktor vzniku zánětu, atrofické gastritidy a histologického vývoje k žaludečnímu adenokarcinomu.
V patogenezi onemocnění se uplatňují různé faktory virulence této bakterie. Přirozený průběh infekce se může lišit v závislosti na genetických dispozicích bakterie a hostitele a v závislosti na prostředí.
Faktory virulence
S faktory virulence Helicobacter pylori jsou spjaty čtyři genetické lokusy:
- cag PAI (cag Pathogenicity Island) – je patogenetický ostrůvek kódující několik proteinů. Jeden z nich kóduje sekreční systém schopný translokovat CagA (protein kódovaný také v rámci cag PAI) do žaludečních epitelových buněk. Tyrosinové zbytky internalizovaného CagA proteinu jsou fosforylovány kinázami rodiny SRC. Fosforylovaný CagA následně aktivuje ERK a tyrosinfosfotázu-2 obsahující SH2 doménu (SRC-homologní 2 doménu). Tento proces se projeví morfologickou proměnou epitelií žaludku. Kmeny H. pylori obsahující funkční cag PAI mohou indukovat produkci prozánětlivých modulátorů (např. IL-8).
- vacA gen – tento gen kóduje vakuolizační cytotoxin. Cytotoxin funguje jako napěťově řízený kanál pro hydrogenuhličitanové a organické anionty. Indukuje tvorbu vakuol v eukarytoních buňkách a stimuluje apoptózu epitelií.
- babA gen – kóduje protein vnější membrány BabA bakterie, který se váže na antigenkrevní skupiny Lewis B přítomný na membránách žaludečních buněk. Zprostředkovává tak těsnou a pevnou adhezi Helicobacter pylori na žaludeční stěnu.
- iceA gen – je gen pravděpodobně spjatý s faktory virulence. Jeho funkce není zcela známa. Exprese tohoto genu je indukována kontaktem bakterie s žaludeční stěnou a u některých lidí je sdružen s vyšším rizikem žaludečního vředu.
Prozánětlivé působení H. pylori
H. pylori svými faktory virulence podněcuje zánětlivou odpověď na žaludeční stěně.
Jedna z cest působení bakterie je přes sekreční systém vytvořený geny cag-PAI. Vytvořený kanál (T4SS – Type 4 secretion system) umožňuje přenést protein CagA přes membránu epitelové buňky žaludku. Po jeho fosforylaci se následně aktivuje kaskáda MAP-kináz (mitogen-activating proteinkinase) vedoucí k aktivaci NFκB (nukleární faktor κB) a AP1 (aktivator protein 1), což vede k produkci prozánětlivých faktorů. Stejně tak může přes T4SS projít i proteoglykan (PG) stěny gramnegativní bakterie, který cestou NOD1 (nucleotide-binding oligomerization domain-1) a RICK (receptor-interacting serine-threonine kinase, RIP2) aktivuje rovněž NFκB a tím i produkci cytokinů a dalších zánětlivých mediátorů.
H. pylori ovšem může svým lipopolysacharidem působit i skrze TLR4 (toll-like receptor 4), čímž rovněž přes NFκB podněcuje zánětlivou reakci.
Role imunitního systému
V patogenezi žaludečního karcinomu hrají důležitou roli také mechanismy imunitní reakce hostitele vůči poškození např. H. pylori. Experimentální infekce myší bez T a B-lymfocytů bakterií Helicobacter nevedla ke změnám žaludeční sliznice. Infekce Helicobacter spp. u myší bez B buněk, ale schopných normální T-lymfocytární odpovědi, došlo k závažné atrofii a metaplázii sliznice. Další pokusy ukázaly, že v patogenezi atrofické gastritidy se podílí konkrétně Th1 buňky.
Pokusy a myších rovněž naznačily, že během chronického zánětu může dojít k náboru hemopoetických buněk z kostní dřeně, kmenových buněk, endoteliálních či epiteliálních progenitorů nebo myofibroblastů. Tyto buňky se usídlují v zánětlivé tkáni a s největší pravděpodobností se podílejí na progresi onemocnění.
Přítomnost zánětlivých mediátorů představuje pro kmenové buňky nefyziologické prostředí, ve kterém tudíž může dojít k metaplázii až dysplázii. Dále zvýšená produkce IL-1β způsobuje snížené vylučování žaludečních kyselin. Zvýšené pH je příznivé pro růst bakterií. Jen málo druhů bakterií dokáže přežít v žaludku při normální sekreci žaludečních kyselin. Naproti tomu při pH > 4.0 je schopna růst již rozsáhlá škála druhů.
Ačkoli by se zdálo, že podávání inhibitorů protonové pumpy (PPIs) při refluxní esofagitidě může zvýšením pH dramaticky zvýšit riziko atrofické gastritidy, dosavadní studie na toto téma jsou rozporuplné a většinou žádnou souvislost neprokazují.
Nesmíme zapomenout ani na zvýšenou produkci volných radikálů v důsledku zánětu. Tvorba ROS (reactive oxygen species, např. v přirozené neutrofilní imunitní reakci) a RNS (reactive nitrogen species, např. v důsledku stimulace iNOS - inducibilní NO syntázy - prostřednictvím NFκB) vede k dalšímu poškozování tkáně, buněčných struktur a také k četným mutacím DNA.
Molekulární mechanismy
Molekulární mechanismy karcinomu žaludku zahrnují poruchy a mutace protoonkogenů (c-met, c-erbB2), tumorsupresorových genů (p53, APC, RARβ, rodina RUNX), molekul buněčné adheze (E-kadherin, CD44) a molekul kontrolujících buněčný cyklus (cyklin E, p27, E2F). Další genetické abnormality se mohou týkat nestability mikrosatelitních sekvencí (spojené s mutacemi mismatch-repair genů), růstových faktorů a cytokinů. Tyto faktory se mohou uplatnit v karcinogenezi ať už zvýšenou proliferací buněk, poruchou opravných mechanismů DNA buňky, nekontrolovaným růstem či stimulací růstu okolních buněk. Zde se popisuje i vliv potravy, neboť dusičnany přítomné v potravinách (např. uzeninách, ale i zelenině) mohou být redukovány na dusitany a případně až na nitrosaminy, které mají mutagenní účinky.
Odkazy
Poznámky
- V tomto článku je použit text článku Karcinom žaludku ve WikiSkriptech českých a slovenských lékařských fakult zapojených v MEFANETu.
Literatura
- Smith MG, Hold GL, Tahara E, El-Omar EM. Cellular and molecular aspects of gastric cancer. World J Gastroenterol 12:2979-2990 (2006).
- Fox JG, Wang TC. Inflammation, atrophy, and gastric cancer. J Clin Invest 117:60–69 (2007).
Externí odkazy
 Obrázky, zvuky či videa k tématu rakovina žaludku na Wikimedia Commons
Obrázky, zvuky či videa k tématu rakovina žaludku na Wikimedia Commons - 1. lékařská fakulta UK, MUDr. Petra Tesařová, CSc. - Karcinom žaludku (přednáška, PDF)
Média použitá na této stránce
This cancer presented in a 40-year-old woman complaining of abdominal pain. Endoscopically it was a "very suspicious" ulcer. Biopsy showed diffusely infiltrating signet ring cell adenocarcinoma. These are gross photos of the subtotal gastrectomy specimen. The photo above is asen face view of the ulcer. The pyloric margin is to the left. The ulcer is on the lesser curvature.
Photograph by Ed Uthman, MD. Public domain. Posted 3 Jan 99