Karcinom děložního hrdla
| Karcinom děložního hrdla | |
|---|---|
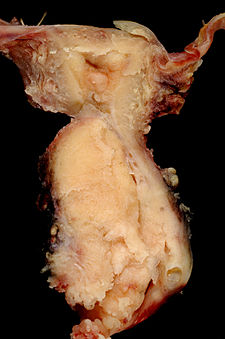 Spinocelulární karcinom děložního hrdla | |
| Klasifikace | |
| MKN-10 | C53. |
| Klinický obraz | |
| Příčiny nebo rizikové faktory | infekce HPV |
| Některá data mohou pocházet z datové položky. | |
Karcinom děložního hrdla nebo též karcinom děložního čípku je zhoubný nádor děložního hrdla. Jde o sedmé nejčastější zhoubné onemocnění a tvoří 4 % všech maligních onemocnění.[1][2]
Výskyt je nejčastější mezi 35. až 45. a mezi 60. až 65. rokem života, s tendencí poklesu do nižších věkových skupin. Celkově dochází k poklesu případů i úmrtnosti, v některých zemí až na 40 % v porovnání se 70. lety 20. století. Příčinou je cytologický screening, který zachycuje značné množství prekanceróz (přednádorových stavů), které jsou následně léčeny, a nepřejdou tak do stádia invazivního karcinomu.[3] Překancerózy přecházejí do stádia invazivního karcinomu zhruba po deseti letech; zároveň jsou vzniklé invazivní karcinomy u mladších žen všeobecně zhoubnější (agresivnější). Včasné odhalení tak znamená nižší stádium onemocnění, větší šanci na uzdravení a celkové snížení úmrtnosti na toto zhoubné onemocnění. Průměrné přežití pěti let od diagnózy se v současnosti ve vyspělých zemích pohybuje na úrovni 65 až 70 %.[4]
Patogeneze

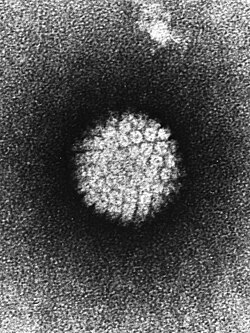
Hlavní příčinou karcinomu děložního hrdla je infekce jeho epitelu jedním z typů lidského papilomaviru (HPV, z anglického human papilloma virus). Vysoce rizikové typy jsou zejména HPV-16 a HPV-18.[5] Infikovaných je 5 až 20 % žen, přičemž spontánní vyléčení je běžné. Riziko se zvyšuje ve spojení s dalšími faktory: sexuální promiskuita, špatná hygiena, vícečetné těhotenství, snížená imunita (AIDS), dlouhodobé užívání hormonální antikoncepce, kouření, genetická predispozice.
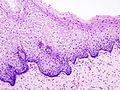
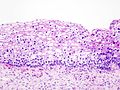
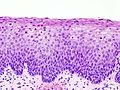
Absolutně nejčastějším typem karcinomu děložního hrdla je epidermoidní karcinom, který se postupně vyvíjí z místního růstu epitelu, přes jednotlivé stupně dysplasie až do pravé prekancerózy. Stádia prekancerózy se označují zkratkou LSIL nebo HSIL (low grade a high grade) a neléčená se mohou vyvinout zpočátku v lokální (karcinom in situ), později invazivní karcinom. Změny typicky začínají v místě přechodu dlaždicového epitelu děložního hrdla do cylindrického epitelu cervikálního kanálu. Výskyt dysplazií se odhaduje na 3 až 5 % dospělých žen.
Rizikové typy papilomaviru (16 a 18) se přenáší sexuálním kontaktem, ale nakažlivost je nízká. Imunitní systém však u 80 až 90 % nakažených žen infekci spontánně vyeliminuje dříve, než se projeví počáteční stadium LSIL (ještě předtím často cytologická laboratoř popisuje tzv. ASCUS, tj. hraniční nález), které navíc ve většině případů spontánně vymizí. Pouze u 1 % žen nakažených rizikovými typy viru se do 15 až 20 let po nákaze vyvine rakovina, ale toto riziko se pravidelnými preventivními prohlídkami (screeningem) snižuje na pětinu.[6]
- Normální cervikální epitel
(Barvení HE) - CIN I
- CIN II
- CIN III
Screening
Včasný a plošný screening ve vyspělých zemích výrazně snížil výskyt (incidenci) i úmrtnost (mortalitu) na rakovinu děložního hrdla. Pro jeho úspěch je zásadní dlouhý časový interval od vzniku prekancerózy po rozvoj invazivního zhoubného nádoru a přístupnost děložního hrdla vyšetření. Díky screeningu se více než 80 % případů zachytí v I. stádiu. Screening se mírně liší v různých zemích. U nás je zatím založen na každoroční kolposkopii (prohlédnutí čípku pod zvětšením) a cytologickém stěru z čípku. Nově se zavádí do plánu prenence také provedení testu na přítomnost papilomaviru ve stěru z čípku (HPV test) pro některé věkové a rizikové kategorie. A samozřejmě nejlepší prevencí je očkování. K němu máme t.č. na trhu několik různých vakcín, které fungují proti 2,4 nebo 9 typům papilomaviru. Podle toho se také odvíjí jejich cena. Pohybuje se cca mezi 2 a 4,5 tisíci za jednu dávku, pro starší než 13leté pacientky jsou potřeba 3 dávky v průběhu půl roku (max.1 roku). 13leté dívky (i chlapci) mají očkování 2 dávkami základní vakcínou zdarma. Další prevencí je obřízka u mužů. Genitální HPV infekce je přenášena především sexuálním přenosem (smegma přenáší papilomaviry). [7]
Příznaky
Rané stádium karcinomu děložního hrdla nemá žádné klinické příznaky, prekancerózní stadia jsou však zjistitelná screeningem. Klinické příznaky se objevují až později, když je nádor už často značně pokročilý. K nejtypičtějším patří krvácení mimo menstruační cyklus, výtok a bolest při souloži (dyspareunie). Bolesti pánve a kříže už často svědčí pro prorůstání rakoviny do okolí. Postihnutí lymfatických uzlin se může projevit jednostranným otokem nohy.
Pokročilé formy provází často ascites, hubnutí a celkové snížení tělesné výkonnosti.
Patologie
Jako karcinom děložního hrdla je různorodá skupina zhoubných nádorů. Nejčastější je rohovatějící a nerohovatějící epidermoidní karcinom (80 % případů) a adenokarcinom (15 % případů).[8] Výskyt adenokarcinomu se v poslední době zvyšuje, je spojený s chronickým zánětem děložního hrdla a zvýšenou hladinou estrogenu, vyznačuje se rychlejším růstem (i během jednoho roku) a má o něco horší prognózu (vyšší pravděpodobnost recidivy, tendence k infiltrativnímu růstu, problematičtější histologická i zobrazovací diagnostika).
Specifickou formou adenokarcinomu s 3% výskytem je tzv. adenoma malignum. Ačkoliv je to dobře diferencovaný mucinózní adenokarcinom, má velmi špatnou prognózu: rychle metastazuje, špatně reaguje na radio- i chemoterapii a navíc se problematicky diagnostikuje. Má totiž podobný vzhled jako běžné a nezhoubné cysty děložního hrdla. Tento typ nádoru je častý u pacientek trpících Peutzovým-Jeghersovým syndromem.[9]
K vzácnějším typům karcinomu děložního hrdla dále patří prognosticky špatný adenoskvamózní karcinom (3% výskyt). Ostatní jsou vzácné a rovněž většinou prognosticky nepříznivé: malobuněčný karcinom a další neuroendokrinní nádory.
Karcinom děložního hrdla většinou vzniká na rozhraní dlaždicového epitelu, který pokrývá plochu hrdla obrácenou do pochvy, a cylindrického epitelu, který vystýlá kanál děložního hrdla, spojující pochvu s dutinou dělohy. Většinou roste exofyticky, tedy ve formy polypu směrem do pochvy, ale není vzácná ani endofytická forma – ať již ve formě vředu nebo expanze šířící se směrem k tělu dělohy.
Staging
Nejpoužívanějším systémem určeným k hodnocení pokročilosti karcinomu děložního hrdla je FIGO (anglicky: International Federation of Gynecology and Obstetrics).[10] Tento systém však nezohledňuje moderní diagnostické metody jako CT či MRI a byl založený primárně na nálezu při gynekologických vyšetřeních, což mělo za následek jeho poměrně nízkou přesnost.[11] Navíc nezohledňuje stav lymfatických uzlin, který je pro pacientovu prognózu rozhodující. Z těchto důvodů se postupně prosazuje TNM klasifikace podle AJCC (American Joint Committee on Cancer) a UICC (United International Cancer Congress).[12]
| TNM | FIGO | |
|---|---|---|
| TX | - | Primární nádor (TU) se nedá posoudit |
| - | 0 | Dysplasie nebo cervikální invazivní neoplazie (CIN) |
| Tis | 0 | Karcinom in situ (CIN III) |
| T1 | stádium I | TU ohraničený na děložní hrdlo (prorůstání do děložního hrdla se nebere v potaz) |
| T1 | IA | Invazivní karcinom identifikovatelný jen mikroskopicky |
| T1 | IA1 | Stromální invaze do hloubky a maximálně 3 mm a do šířky maximálně 7 mm |
| T1 | IA2 | Stromální invaze do hloubky a maximálně 5 mm a do šířky maximálně 7 mm |
| T1 | IB | Stromální invaze do hloubky větší než 5 mm nebo do šířky větší než 7 mm, nebo klinicky identifikovatelný tumor ohraničení na děložní hrdlo |
| T1 | IB1 | Klinicky identifikovatelný tumor menší než 4 cm |
| T1 | IB2 | Klinicky identifikovatelný tumor větší než 4 cm |
| T2 | stádium II | Nádor šířící se mimo děložní hrdlo nebo nepostihující boční stěny pánve nebo dolní třetinu pochvy |
| T2 | IIA | TU infiltruje stěnu pochvy, ale ne její dolní třetinu |
| T2 | IIB | TU infiltruje parametria |
| T3 a/nebo N1 | stádium III | Šíření TU do dolní třetiny pochvy nebo se šíří na pánevní stěnu, či způsobuje hydronefrózu |
| T3aN0 | IIIA | TU postihuje dolní třetinu pochvy |
| T1-3bN1 | IIIB | TU se šíří na boční stěnu pánve nebo způsobuje hydronefrózu či afunkční ledvinu |
| stádium IV | ||
| T4 | IVA | TU infiltruje stěnu močového měchýře nebo konečníku, nebo se šíří mimo malou pánev |
| M1 | IVB | TU má vzdálené metastázy |
MRI a CT jsou optimální zobrazovací metody na predoperační staging a následné sledování pacientů s rakovinou děložního hrdla. Onkomarkery mají nízkou senzitivitu a specifičnost, proto se běžně v této indikaci nepoužívají.[13]
Karcinom děložního hrdla metastazuje do lymfatických uzlin; nejdříve v oblasti fossa obturatoria a podél vnějších, vnitřních a společných iliackých cév, do presakrálních a nakonec paraaortálních lymfatických uzlin (postižení paraaortálních lymfatických uzlin se již považuje za vzdálené metastázy). Riziko postižení lymfatických uzlin se stupněm pokročilosti nádoru je ve stádiu IIA přibližně 25 %.[14]
Rozsev hematogenní (krevním řečištěm) cestou je vzácný a vyskytuje se jen v pokročilém stádiu. Nejčastěji jsou postiženy plíce a skelet (kosti).
Zobrazovací diagnostika
Pro správné zhodnocení nálezu potřebuje radiolog kromě anamnézy i informace o léčby (zejména radioterapii a hormonální léčbě), chirurgických zákrocích ve vyšetřované oblasti (druh i čas) a vědět aktuální stádium menstruačního cyklu. Mezi druhy zobrazovacích diagnostik patří:[15]
Magnetická rezonance
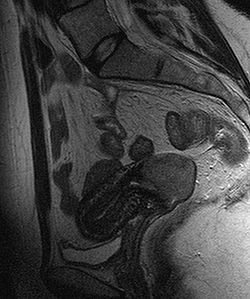
Metodou první volby v určení lokálního rozsahu onemocnění od stádia IB je magnetická rezonance (MRI). Celková senzitivita metody je 95 %).[16] Poskytuje zásadní informace pro rozhodnutí o způsobu léčby (operace či radioterapie). Informuje o velikosti nádoru a jeho případném šíření do okolí. Je nejpřesnější zobrazovací metodou pro odlišení karcinomu ohraničeného na děložní hrdlo od karcinomu infiltrujícího okolní struktury (zejména parametria, přesnost je více než 90%).[17] Klinické vyšetření je nejpřesnější v odhadu infiltrace do parametrií, močového měchýře a konečníku, naopak kolposkopie je přesnější v hodnocení infiltrace pochvy.
Většina pacientek má v době vyšetření již histologicky stanovenou diagnózu a MR vyšetření je tedy určené primárně na posouzení rozsahu, ne na detekci onemocnění.
Magnetická rezonance se také považuje za nejlepší zobrazovací metodu pro plánování radiochemoterapie a pro sledování lokální reakce na léčbu. Po šesti měsících od operace je MR schopná zodpovědně odlišit pooperační jizvovitou tkáň od lokální recidivy onemocnění.
Magnetická rezonance nedokáže vzájemně odlišit jednotlivé histologické typy karcinomu děložního hrdla. Problematické je zobrazení zejména při malých adenokarcinomech, které rostou difuzně a jejichž signál je podobný signálu okolní stromatů.
Průběh vyšetření
Pacientka nemusí být nalačno více než 2 až 3 hodiny. Doporučuje se mírně naplněný močový měchýř. Vyšetřuje se v poloze na zádech a na omezení pohybových artefaktů střevní peristaltiky se podává spazmolytikum (většinou Buscopan). Při vyšetření se používají povrchové „phased-array“ cívky, které umožňují snímání s vysokým rozlišením a odstupem signál-šum. Endorektální a endovaginální cívky se používají vzácně. Nastavuje se malá oblast zájmu (anglicky: field of view, FOV) s využitím tzv. fázového oversamplingu (brání artefaktům v „překlopení“ obrazu) a presaturace přední břišní stěny (cílem je odstranit rušivý signál z jejího pohybu při dýchání.
Základem pro zobrazení karcinomu děložního hrdla je T2 vážení (přístroj s hodnotou magnetického pole 1-3T, matrix 512, hloubka řezů 4–5 mm, fázové rozlišení nejméně 75 %), přičemž se vyšetřuje minimálně ve dvou rovinách (nejprve v dlouhé ose hrdla – sagitální rovina, poté kolmo na dlouhou osu – tranzverzální či šikmá tranzverzální rovina). Součástí standardního protokolu na určení stádia onemocnění by mělo být i vyšetření paraaortálních lymfatických uzlin (tedy kromě pánve i vyšetření dolního břicha). Ke standardním sekvencím dále patří tranzverzální sekvence v T1 vážení (6mm, matrix 512, fázové rozlišení nejméně 60 %), určená na posouzení bočních stěn pánve a lymfatických uzlin. Podávání nitrožilní kontrastní látky není při primárním stagingu potřebné, v individuálních případech může pomoci při identifikaci infiltrace rakoviny do stěny močového měchýře či konečníku.[18] Podání kontrastní látky s následným rychlým dynamickým vyšetřením (ultrarychle T1 GRE sekvence) je naopak potřebné při rozlišení recidivy rakoviny od pooperačních a poradiačních změn.
Při podezření na infiltraci pochvy se pro ideální zobrazení doporučuje naplnit pochvu sonografickým gelem. Tuto přípravu považují některá centra za poměrně kontroverzní – infiltraci je možné s podobnou citlivostí zhodnotit i při gynekologickém vyšetření, roztáhnutá pochva narušuje přehlednost okolních anatomických poměrů a navíc je příprava pro pacientku poměrně nepříjemná.
Další sekvence jsou volitelné a závisí na rozsahu onemocnění, preferencích radiologa a požadovaných informacích: ischemické sekvence v T2 vážení a MR urografie na posouzení případné infiltrace močovodů, T1 vážené sekvence po podání kontrastní látky v minimálně 2 rovinách a T2 vážené sekvence po potlačení signálu tuku při pátrání po píštělech (komplikace radiochemoterapie) a další.
Počítačová tomografie
Počítačová tomografie (CT) se na posouzení lokálního rozsahu karcinomu děložního hrdla používá méně často; důvodem je její nižší tkáňový kontrast a tím pádem nižší přesnost. Je však ideální metodou na posouzení šíření onemocnění mimo pánev (70 %). Její největší výhodou je rychlost a vysoké prostorové rozlišení. Při vyšetření je kromě podání kontrastní látky do krevního oběhu vhodné podat i kontrastní látku per os (vypitím) a per rectum (do konečníku v podobě vodní klyzmy).
CT je hlavní zobrazovací metodou pro plánování radioterapie.
Pozitronová emisní tomografie
Pozitronová emisní tomografie (PET) a její použití v rámci karcinomu děložního hrdla je dosud ve stádiu výzkumu a používá se v současnosti spíše individuálně při problematických případech.
Ultrasonografie
Ultrasonografie (USG), zejména endovaginální, hraje při diagnostice a sledování karcinomu děložního hrdla čím dál větší roli, samozřejmě v závislosti na erudici vyšetřujícího. Transabdominální USG má význam v detekci ascitu či přítomnosti metastáz v játrech, méně pak v retroperitoneálních lymfatických uzlinách.
Léčba
Léčba karcinomu děložního hrdla závisí na stádiu onemocnění.
- lehká dysplazie (LSIL)– jen pozorování, často spontánní ústup
- střední a těžká dysplasie (HSIL)– konizace (odstranění části děložního čípku)
- stádium I až IIA (individuálně i IIB) – primárně chirurgická léčba (preferuje se u mladších), alternativně IB a IIA i radikální radioterapie
Chirurgická léčba
Mikroinvazivní typ ve stádiu IA1 je možné řešit konizací nebo jednoduchou hysterektomií.[19] U vyšších stádií (IB a IIA) se přistupuje k radikální hysterektomii (podle Wertheima) s odstraněním dělohy, parametrií a horní částí pochvy, včetně parakolpií. Součástí zákroku je v případě nálezu invaze karcinomu do cév i intrapelvická a paaortální lymfadenektomie (odstranění lymfatických uzlin). U mladých žen, které si chtějí zachovat plodnost, existuje možnost tzv. radikální trachelektomie kombinované s lymfadenektomií. Vyžaduje však velmi zkušeného operatéra.[20]
Nejradikálnější operací je tzv. exenteracie pánve. Je možné k ní přistoupit u pokročilých nádorů či recidiv s prorůstáním do okolních orgánů (močový měchýř, konečník), ale ne do pánevních stěn, s cílem jej kompletně odstranit. Při přísném výběru vhodných pacientů je 5roční přežití až 82 %; operace značně snižuje kvalitu života (kolostomie, ureterostomie).[21]
Radiochemoterapie
Používá se primárně nebo jako neoadjuvantní léčba (léčba před operací s cílem zmenšit nádor). Radikální radioterapie je součástí léčby stádia IIB a vyšších.[22] Pooperační radiochemoterapie se aplikuje pacientům, u kterých je vyšší riziko recidivy (velký objem nádorové masy, pozitivní resekční linie, malý bezpečnostní lem, cévní invaze, adenokarcinom, světlobuněčný karcinom). Pokročilá stádia (FIGO III a IV) jsou chirurgicky neléčitelná a léčí se radiochemoterapií.
Radioterapie může být externí (zářič je vně těla pacienta) nebo tzv. brachyterapie (zářič se dočasně zavádí přímo do těla). Externí radioterapie se využívá při ozařování pánevních a paraaortálních lymfatických uzlin a parametrií (do 45 Gy).[23] Brachyterapie je kontraindikovaná u pacientek s prorůstáním karcinomu do močového měchýře nebo konečníku kvůli riziku vzniku píštěle.
Prognóza
Nejdůležitějším prognostickým faktorem je velikost nádoru a přítomnost metastáz v lymfatických uzlinách. Gynekologické vyšetření má sklon skutečnou velikost podcenit. MRI dokáže identifikovat nádory od velikosti 1 cm a objektivně stanovit jejich velikost (objem); v případě vnějšího edému naopak skutečnou velikost spíše přeceňuje.
Nepříznivé prognostické faktory (faktory svědčící pro horší průběh onemocnění) jsou invaze nádorových buněk do cévního systému, pokročilé stádium onemocnění, postižení lymfatických uzlin, nádor větší než 4 cm a v neposlední řadě výskyt v mladém věku. Ve stádiu IA přežívá 5 roků celkem 95 % pacientek, ve stádiu IIB už jen 73 % a při vzdálených metastázích je to pouze 20 %.[24] Rozšíření nádoru a paraaortálních lymfatických uzlin snižuje dobu přežití na polovinu. Prognóza recidivujícího karcinomu je velmi variabilní, od 10 až po 70 %, podle způsobu léčby a charakteru recidivy.
Ostatní vzácné zhoubné nádory děložního hrdla
Metastáze
Do oblasti děložního hrdla nejčastěji metastazuje, či přímo z dělohy prorůstá endometriální karcinom.
Melanom
Melanom se u žen z 1 až 3 % vyskytuje v oblasti genitálu, nejčastěji v poševní sliznici, odkud přímo prorůstá na děložní hrdlo. Primární maligní melanom děložního hrdla je vzácný.
Lymfom
Lymfom do oblasti děložního hrdla prorůstá zejména z okolních oblastí. Primární lymfom dělohy tvoří pouze 2 % všech mimouzlinových maligních lymfomů a nejčastěji postihuje právě děložní hrdlo. V oblasti děložního těla převažuje infiltrativní růst, který se projeví jeho celkovým výrazným zvětšením.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Rakovina krčka maternice na slovenské Wikipedii.
- ↑ BRAY, F., a kolektiv. Estimates of cancer incidence and mortality in Europe in 1995. European Journal of Cancer. 2002, roč. 38, čís. 1, s. 99–166. Dostupné v archivu pořízeném dne 2016-03-05. ISSN 0959-8049. (anglicky) Archivováno 5. 3. 2016 na Wayback Machine.
- ↑ PARKIN, D. M., a kolektiv. Global cancer statistics. A Cancer Journal of Clinicians. 2002, roč. 74, čís. 2, s. 74–108. Dostupné v archivu pořízeném dne 2009-08-02. ISSN 1542-4863. (anglicky) Archivováno 2. 8. 2009 na Wayback Machine.
- ↑ GUSTAFSSON, Leif, a kolektiv. International incidence rates of invasive cervical cancer before cytological screening. International Journal of Cancer. 1997, roč. 71, čís. 2, s. 159–165. Dostupné online. ISSN 1097-0215. (anglicky)[nedostupný zdroj]
- ↑ BRENNER, Hermann. Long-term survival rates of cancer patients achieved by the end of the 20th century: a period analysis. S. 1131–1135. The Lancet [online]. 2002-10 [cit. 2020-11-25]. Roč. 360, čís. 9340, s. 1131–1135. doi:10.1016/S0140-6736(02)11199-8. (anglicky)
- ↑ LORINCZ, Attila T; CASTLE, Philip E; SHERMAN, Mark E; SCOTT, David R; GLASS, Andrew G; WACHOLDER, Sholom; RUSH, Brenda B. Viral load of human papillomavirus and risk of CIN3 or cervical cancer. S. 228–229. The Lancet [online]. 2002-07 [cit. 2020-11-25]. Roč. 360, čís. 9328, s. 228–229. doi:10.1016/S0140-6736(02)09463-1. (anglicky)
- ↑ http://www.wikiskripta.eu/index.php/Lidsk%C3%BD_papillomavirus
- ↑ https://theses.cz/id/yvyuil/loha-papilomavir_-v-etiologii-ndor_-ano-genitln-oblasti-m.pdf
- ↑ JENKINS, David. Histopathology and Cytopathology of Cervical Cancer. S. 199–212. Disease Markers [online]. 2007 [cit. 2020-11-25]. Roč. 23, čís. 4, s. 199–212. Dostupné online. doi:10.1155/2007/874795. PMID 17627056. (anglicky)
- ↑ Adenoma malignum of the cervix [online]. Geneva Foundation for Medical Education and Research [cit. 2009-08-08]. Dostupné v archivu pořízeném dne 2007-08-06. (anglicky)
- ↑ Benedet JL et all. FIGO staging classifications and clinical practice guidelines in the management of gynecologic cancers. FIGO Committee on Gynecologic Oncology. Int J Gynaecol Obstet 70 (2000): 209–62.
- ↑ HO, C. M.; CHIEN, T. Y.; JENG, C. M.; TSANG, Y. M.; SHIH, B. Y.; CHANG, S. C. Staging of cervical cancer: comparison between magnetic resonance imaging, computed tomography and pelvic examination under anesthesia. S. 982–990. Journal of the Formosan Medical Association = Taiwan Yi Zhi [online]. 1992-10 [cit. 2020-11-25]. Roč. 91, čís. 10, s. 982–990. ISSN 0929-6646. PMID 1362678. (anglicky)
- ↑ UICC - TNM classification of malignant tumours [online]. United International Cancer Congress [cit. 2009-08-08]. Dostupné online. (anglicky)
- ↑ ENGIN, Gulgun. Cervical cancer: MR imaging findings before, during, and after radiation therapy. S. 313–324. European Radiology [online]. 2006-02 [cit. 2020-11-25]. Roč. 16, čís. 2, s. 313–324. doi:10.1007/s00330-005-2804-z. PMID 16425027. (anglicky)
- ↑ METCALF, K. S.; JOHNSON, N.; CALVERT, S.; PEEL, K. R. Site specific lymph node metastasis in carcinoma of the cervix: Is there a sentinel node?. S. 411–416. International Journal of Gynecological Cancer [online]. 2000-09-05 [cit. 2020-11-25]. Roč. 10, čís. 5, s. 411–416. doi:10.1046/j.1525-1438.2000.010005411.x. (anglicky)
- ↑ Baert AL, Knauth M, Sartor K. MRI and CT of the Female Pelvis. Springer, 2007.
- ↑ TOGASHI, K; NISHIMURA, K; SAGOH, T; MINAMI, S; NOMA, S; FUJISAWA, I; NAKANO, Y. Carcinoma of the cervix: staging with MR imaging.. S. 245–251. Radiology [online]. 1989-04-01 [cit. 2020-11-25]. Roč. 171, čís. 1, s. 245–251. doi:10.1148/radiology.171.1.2928532. (anglicky)
- ↑ JENA, A; OBEROI, R; RAWAL, S; DAS, S K; PANDEY, K K. Parametrial invasion in carcinoma of cervix: role of MRI measured tumour volume. S. 1075–1077. The British Journal of Radiology [online]. 2005-12 [cit. 2020-11-25]. Roč. 78, čís. 936, s. 1075–1077. doi:10.1259/bjr/36116150. (anglicky)
- ↑ Hawighorst H. et al. Invasive cervix carcinoma (pT2b–pT4a). Value of conventional and pharmacokinetic MRI in comparison with extensive cross sections and histopathologic findings. Radiology 37 (1997):130–138.
- ↑ Schorge JO et all. Prospective management of stage IA(1) cervical adenocarcinoma by conization alone to preserve fertility: a preliminary report. Gynecol Oncol 78 (2000): 217–20.[1] Archivováno 20. 8. 2009 na Wayback Machine.
- ↑ Covens A et all. Is radical trachelectomy a safe alternative to radical hysterectomy for patients with stage IA–B carcinoma of the cervix? Cancer 86 (1999):2273–79.*.pdf, eng[nedostupný zdroj]
- ↑ Holtz DO et all. Traditional management of invasive cervical cancer. Obstet Gynecol Clin North Am 29 (2002):645–57.
- ↑ Cancer research UK [online]. Cancer Research UK [cit. 2009-08-08]. Dostupné online. (anglicky)
- ↑ Stewart AJ et all. Current controversies in high-dose-rate versus low-dose-rate brachytherapy for cervical cancer. Cancer 107 (2006): 908-15.
- ↑ Cervical Cancer Survival Rates [online]. 2006-12-2 [cit. 2009-08-08]. Dostupné v archivu pořízeném dne 2009-02-06. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu rakovina děložního hrdla na Wikimedia Commons
Obrázky, zvuky či videa k tématu rakovina děložního hrdla na Wikimedia Commons - Očkování proti rakovině děložního čípku – Informace o očkování proti HPV
- (česky) Univerzita Karlova, 1. lékařská fakulta – E-learningová přednáška Pavla Freitaga o karcinomu děložního hrdla
- (česky) Univerzita Karlova, 1. lékařská fakulta – E-learningová přednáška Pavla Freitaga o prekancerózách děložního hrdla
- (česky) HPV asociované cervikální léze – Karcinom děložního čípku
- (anglicky) National Cancer Institute – Rakovina děložního hrdla
- Vakciny.cz – Informace o očkování a ochraně proti onemocněním pro širokou veřejnost v ČR

Přečtěte si prosím pokyny pro využití článků o zdravotnictví.
Média použitá na této stránce
Star of life, blue version. Represents the Rod of Asclepius, with a snake around it, on a 6-branch star shaped as the cross of 3 thick 3:1 rectangles.
Design:
The logo is basically unicolor, most often a slate or medium blue, but this design uses a slightly lighter shade of blue for the outer outline of the cross, and the outlines of the rod and of the snake. The background is transparent (but the star includes a small inner plain white outline). This makes this image usable and visible on any background, including blue. The light shade of color for the outlines makes the form more visible at smaller resolutions, so that the image can easily be used as an icon.
This SVG file was manually created to specify alignments, to use only integers at the core 192x192 size, to get smooth curves on connection points (without any angle), to make a perfect logo centered in a exact square, to use a more precise geometry for the star and to use slate blue color with slightly lighter outlines on the cross, the rod and snake.
Finally, the SVG file is clean and contains no unnecessary XML elements or attributes, CSS styles or transforms that are usually added silently by common SVG editors (like Sodipodi or Inkscape) and that just pollute the final document, so it just needs the core SVG elements for the rendering. This is why its file size is so small.Pathology: EM: Papilloma Virus (HPV) Electron micrograph of a negatively stained human papilloma virus (HBV) which occurs in human warts. Warts on the hands and feet have never been known to progress to cancer. However, after many years cervical warts can become cancerous.
Autor: No machine-readable author provided. KGH assumed (based on copyright claims)., Licence: CC BY-SA 3.0
Histopathologic image of cervical intraepithelial neoplasia (CIN3). H & E stain.
Autor: No machine-readable author provided. KGH assumed (based on copyright claims)., Licence: CC BY-SA 3.0
Histopathologic image of cervical intraepithelial neoplasia with koilocytosis. H & E stain.
Autor: my own work, Licence: CC BY-SA 3.0
Karcinóm krčka maternice - T2-vážený sagitálny rez maternicou, vyšetrenie magnetickou rezonanciou
Autor: No machine-readable author provided. KGH assumed (based on copyright claims)., Licence: CC BY-SA 3.0
Histopathologic image of normal nonkeratinizing cervical epithelium. H & E stain.
Autor: No machine-readable author provided. KGH assumed (based on copyright claims)., Licence: CC BY-SA 3.0
Histopathologic image of cervical intraepithelial neoplasia (CIN2). H & E stain.
Autor: Ed Uthman, MD., Licence: CC BY 2.0
Squamous Carcinoma of Cervix