Katelicidin
Antimikrobiální peptidy (CAMP) LL-37 a FALL-39 jsou polypeptidy, které jsou primárně uloženy v lysozomech makrofágů a polymorfonukleárních leukocytů (PMN); u lidí gen CAMP kóduje peptidový prekurzor hCAP-18 (18 kDa), který je štěpen proteinázou 3 na aktivní formy LL-37 a FALL-39.[1]
Katelicidiny hrají zásadní roli v přirozené imunitní obraně savců proti bakteriální infekci.[2] Patří společně s defensíny do rodiny antimikrobiálních peptidů (AMP). Zatímco všechny defensíny mají společné strukturální rysy, katelicidiny jsou vysoce heterogenní. Členové rodiny katelicidinových antimikrobiálních polypeptidů jsou charakterizováni vysoce konzervativní oblastí (katelinová doména) a vysoce variabilní katelicidinovou peptidovou doménou.[2]
Katelicidiny byly izolovány z mnoha různých druhů savců. Nacházejí se v neutrofilech, monocytech, žírných buňkách, dendritických buňkách a makrofázích [3] po jejich aktivaci bakteriemi, viry, houbami, parazity nebo hormonem 1,25-D, což je hormonálně aktivní forma vitaminu D.[4] Byly ale nalezeny i v některých dalších buňkách, včetně epitelových buněk, lidských keratinocytů.[5]
Mechanismus antimikrobiální aktivity
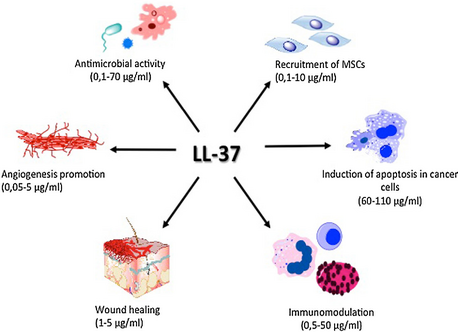
Obecný mechanismus antimikrobiálního účinku katelicidinu, podobně jako u jiných antimikrobiálních peptidů, zahrnuje dezintegraci (poškození a proděravění) buněčných membrán mikroorganismů.[6] Katelicidin rychle ničí lipoproteinové membrány mikrobů obalených ve fagozomech po fúzi s lysozomy v makrofázích . LL-37 proto může inhibovat tvorbu bakteriálních biofilmů.[7]
Další funkce
LL-37 přispívá k aktivaci buněčného dělení a migrace buněk a k procesu hojení ran.[8] Společně tyto mechanismy hrají důležitou roli v homeostáze tkání a regeneračních procesech. Navíc má agonistický vliv na různé pleiotropní receptory, například FPRL1 (formyl peptid receptor-like 1),[9] purinergní receptor P2X7, receptor epidermálního růstového faktoru (EGFR)[10] nebo IGF-1R (insulin-like growth factor-1 receptor).[11] Tyto receptory mají důležitý imunomodulační efekt mimo jiné i v protinádorové imunitě.
Dále indukuje angiogenezi [12] a reguluje apoptózu. [13] Tyto procesy jsou dysregulované během vývoje rakoviny, a proto se zdá, že LL-37 je zapojen do patogeneze maligních nádorů.
Vlastnosti
Velikost katelicidinů je od 12 do 80 aminokyselinových zbytků a má širokou škálu struktur.[14] Většina katelicidinů jsou lineární peptidy s 23-37 aminokyselinovými zbytky a skládají se do amfipatických α-šroubovic . Kromě toho mohou být katelicidiny také molekuly malé velikosti (12-18 zbytků) s beta-vlásenkovými strukturami, stabilizované jednou nebo dvěma disulfidickými vazbami. Rovněž existují větší varianty (39-80 aminokyselinových zbytků). Tyto větší katelicidiny obsahují opakující se prolinové motivy tvořící rozšířenou polyprolinovou strukturu.
Ortologi
Katelicidiny byly nalezeny u lidí, opic, myší, potkanů, králíků, morčat, pand, prasat, skotu, žab, ovcí, koz, kuřat a koní. U savců bylo popsáno asi 30 členů této rodiny.
V současné době jsou identifikovány tyto katelicidiny:[15][16][17][18]
- člověk: hCAP-18 (LL-37 a FALL-39)
- makak: RL-37
- myš: CRAMP-1/2, (Cathelicidin-related Antimicrobial Peptide
- potkan: rCRAMP
- králík: CAP-18
- morče: CAP-11
- prase: PR-39, Prophenin, PMAP-23,36,37
- skot: BMAP-27,28,34 (Bovine Myeloid Antimicrobial Peptides); Bac5, Bac7
- žába: cathelicidin-AL (Amolops loloensis)
- kuře: fowlicidins 1,2,3 a cathelicidin Beta-1
- tasmánský čert: Saha-CATH5
- lososovití: CATH1 a CATH2
Klinický význam
Pacienti s růžovkou mají zvýšené hladiny katelicidinu a zvýšené hladiny SCTEs (stratum corneum tryptic enzymes). Antibiotika se v minulosti používala k léčbě růžovky, protože inhibují některé SCTE.[19] Katelicidin se štěpí na antimikrobiální peptid LL-37 serinovými proteázami kalikrein 5 a kalikrein 7. Předpokládá se, že nadměrná produkce LL-37 je příčinou všech podtypů růžovky.[20]
Zdá se, že vyšší hladiny antimikrobiálního proteinu lidského katelicidinu (hCAP18) v krvi významně snižují riziko úmrtí na infekci u dialyzovaných pacientů. U pacientů s vysokou hladinou tohoto proteinu byla 3,7krát větší pravděpodobnost, že přežijí dialýzu ledvin po dobu jednoho roku bez fatální infekce. [21] Produkce katelicidinů je regulována vitamínem D. [22] [23]
SAAP-148 (a synthetic antimicrobial and antibiofilm peptide) je modifikovaná verze LL-37, která má zvýšenou antimikrobiální aktivitu v porovnání s LL-37 a je účinnější při likvidaci bakterií za fyziologických podmínek.[24]
Předpokládá se, že LL-37 hraje roli v patogenezi psoriázy (spolu s dalšími antimikrobiálními peptidy). U psoriázy uvolňují poškozené keratinocyty LL-37, který tvoří komplexy s vlastním genetickým materiálem (DNA nebo RNA) z jiných buněk. Tyto komplexy stimulují dendritické buňky, které poté uvolňují interferon α a β, což přispívá k diferenciaci T-buněk a pokračujícímu zánětu.[25] Bylo také zjištěno, že LL-37 je běžným auto-antigenem u psoriázy; T-buňky specifické pro LL-37 byly nalezeny v krvi a kůži u dvou třetin pacientů se středně těžkou až těžkou formou psoriázy. [25]
Reference
V tomto článku byl použit překlad textu z článku Cathelicidin na anglické Wikipedii.
- ↑ Dostupné online.
- ↑ a b Zanetti M. Cathelicidins, multifunctional peptides of the innate immunity. Journal of Leukocyte Biology. January 2004, s. 39–48. DOI 10.1189/jlb.0403147. PMID 12960280. S2CID 14902156.
- ↑ Vandamme D, Landuyt B, Luyten W, Schoofs L. A comprehensive summary of LL-37, the factotum human cathelicidin peptide. Cellular Immunology. November 2012, s. 22–35. DOI 10.1016/j.cellimm.2012.11.009. PMID 23246832.
- ↑ Liu PT, Stenger S, Li H, Wenzel L, Tan BH, Krutzik SR, Ochoa MT, Schauber J, Wu K, Meinken C, Kamen DL, Wagner M, Bals R, Steinmeyer A, Zügel U, Gallo RL, Eisenberg D, Hewison M, Hollis BW, Adams JS, Bloom BR, Modlin RL. Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response. Science. March 2006, s. 1770–3. DOI 10.1126/science.1123933. PMID 16497887. S2CID 52869005. Bibcode 2006Sci...311.1770L.
- ↑ Bals R, Wang X, Zasloff M, Wilson JM. The peptide antibiotic LL-37/hCAP-18 is expressed in epithelia of the human lung where it has broad antimicrobial activity at the airway surface. Proceedings of the National Academy of Sciences of the United States of America. August 1998, s. 9541–6. DOI 10.1073/pnas.95.16.9541. PMID 9689116.
- ↑ Kościuczuk EM, Lisowski P, Jarczak J, Strzałkowska N, Jóźwik A, Horbańczuk J, Krzyżewski J, Zwierzchowski L, Bagnicka E. Cathelicidins: family of antimicrobial peptides. A review. Molecular Biology Reports. December 2012, s. 10957–70. DOI 10.1007/s11033-012-1997-x. PMID 23065264.
- ↑ Dosler S, Karaaslan E. Inhibition and destruction of Pseudomonas aeruginosa biofilms by antibiotics and antimicrobial peptides. Peptides. December 2014, s. 32–7. DOI 10.1016/j.peptides.2014.09.021. PMID 25285879.
- ↑ Shaykhiev R, Beisswenger C, Kändler K, Senske J, Püchner A, Damm T, Behr J, Bals R. Human endogenous antibiotic LL-37 stimulates airway epithelial cell proliferation and wound closure. American Journal of Physiology. Lung Cellular and Molecular Physiology. November 2005, s. L842-8. DOI 10.1152/ajplung.00286.2004. PMID 15964896.
- ↑ Chen Q, Schmidt AP, Anderson GM, Wang JM, Wooters J, Oppenheim JJ, Chertov O. LL-37, the neutrophil granule- and epithelial cell-derived cathelicidin, utilizes formyl peptide receptor-like 1 (FPRL1) as a receptor to chemoattract human peripheral blood neutrophils, monocytes, and T cells. The Journal of Experimental Medicine. October 2000, s. 1069–74. DOI 10.1084/jem.192.7.1069. PMID 11015447.
- ↑ von Haussen J, Koczulla R, Shaykhiev R, Herr C, Pinkenburg O, Reimer D, Wiewrodt R, Biesterfeld S, Aigner A, Czubayko F, Bals R. The host defence peptide LL-37/hCAP-18 is a growth factor for lung cancer cells. Lung Cancer. January 2008, s. 12–23. DOI 10.1016/j.lungcan.2007.07.014. PMID 17764778.
- ↑ Girnita A, Zheng H, Grönberg A, Girnita L, Ståhle M. Identification of the cathelicidin peptide LL-37 as agonist for the type I insulin-like growth factor receptor. Oncogene. January 2012, s. 352–65. DOI 10.1038/onc.2011.239. PMID 21685939.
- ↑ Koczulla R, von Degenfeld G, Kupatt C, Krötz F, Zahler S, Gloe T, Issbrücker K, Unterberger P, Zaiou M, Lebherz C, Karl A, Raake P, Pfosser A, Boekstegers P, Welsch U, Hiemstra PS, Vogelmeier C, Gallo RL, Clauss M, Bals R. An angiogenic role for the human peptide antibiotic LL-37/hCAP-18. The Journal of Clinical Investigation. June 2003, s. 1665–72. DOI 10.1172/JCI17545. PMID 12782669.
- ↑ Ren SX, Shen J, Cheng AS, Lu L, Chan RL, Li ZJ, Wang XJ, Wong CC, Zhang L, Ng SS, Chan FL, Chan FK, Yu J, Sung JJ, Wu WK, Cho CH. FK-16 derived from the anticancer peptide LL-37 induces caspase-independent apoptosis and autophagic cell death in colon cancer cells. Redakce Nie D. PloS One. 2013-05-20, s. e63641. DOI 10.1371/journal.pone.0063641. PMID 23700428.
- ↑ Gennaro R, Zanetti M. Structural features and biological activities of the cathelicidin-derived antimicrobial peptides. Biopolymers. 2000, s. 31–49. DOI 10.1002/1097-0282(2000)55:1<31::AID-BIP40>3.0.CO;2-9. PMID 10931440.
- ↑ GALLO, R. L.; KIM, K. J.; BERNFIELD, M. Identification of CRAMP, a cathelin-related antimicrobial peptide expressed in the embryonic and adult mouse. The Journal of Biological Chemistry. 1997-05-16, roč. 272, čís. 20, s. 13088–13093. PMID: 9148921. Dostupné online [cit. 2021-01-19]. ISSN 0021-9258. DOI 10.1074/jbc.272.20.13088. PMID 9148921.
- ↑ HAO, Xue; YANG, Hailong; WEI, Ling. Amphibian cathelicidin fills the evolutionary gap of cathelicidin in vertebrate. Amino Acids. 2012-08, roč. 43, čís. 2, s. 677–685. PMID: 22009138. Dostupné online [cit. 2021-01-19]. ISSN 1438-2199. DOI 10.1007/s00726-011-1116-7. PMID 22009138.
- ↑ ACHANTA, Mallika; SUNKARA, Lakshmi T.; DAI, Gan. Tissue expression and developmental regulation of chicken cathelicidin antimicrobial peptides. Journal of Animal Science and Biotechnology. 2012-05-31, roč. 3, čís. 1, s. 15. PMID: 22958518 PMCID: PMC3436658. Dostupné online [cit. 2021-01-19]. ISSN 2049-1891. DOI 10.1186/2049-1891-3-15. PMID 22958518.
- ↑ PEEL, E.; CHENG, Y.; DJORDJEVIC, J. T. Cathelicidins in the Tasmanian devil (Sarcophilus harrisii). Scientific Reports. 10 11, 2016, roč. 6, s. 35019. PMID: 27725697 PMCID: PMC5057115. Dostupné online [cit. 2021-01-19]. ISSN 2045-2322. DOI 10.1038/srep35019. PMID 27725697.
- ↑ Yamasaki K, Di Nardo A, Bardan A, Murakami M, Ohtake T, Coda A, Dorschner RA, Bonnart C, Descargues P, Hovnanian A, Morhenn VB, Gallo RL. Increased serine protease activity and cathelicidin promotes skin inflammation in rosacea. Nature Medicine. August 2007, s. 975–80. DOI 10.1038/nm1616. PMID 17676051. S2CID 23470611.
- ↑ Reinholz M, Ruzicka T, Schauber J. Cathelicidin LL-37: an antimicrobial peptide with a role in inflammatory skin disease. Annals of Dermatology. May 2012, s. 126–35. DOI 10.5021/ad.2012.24.2.126. PMID 22577261.
- ↑ Gombart AF, Bhan I, Borregaard N, Tamez H, Camargo CA, Koeffler HP, Thadhani R; CAMARGO. Low plasma level of cathelicidin antimicrobial peptide (hCAP18) predicts increased infectious disease mortality in patients undergoing hemodialysis. Clinical Infectious Diseases. February 2009, s. 418–24. DOI 10.1086/596314. PMID 19133797.
- ↑ Zasloff M. Antimicrobial peptides of multicellular organisms. Nature. January 2002, s. 389–95. DOI 10.1038/415389a. PMID 11807545. S2CID 205028607. Bibcode 2002Natur.415..389Z.
- ↑ Kamen DL, Tangpricha V. Vitamin D and molecular actions on the immune system: modulation of innate and autoimmunity. Journal of Molecular Medicine. May 2010, s. 441–50. DOI 10.1007/s00109-010-0590-9. PMID 20119827.
- ↑ de Breij A, Riool M, Cordfunke RA, Malanovic N, de Boer L, Koning RI, Ravensbergen E, Franken M, van der Heijde T, Boekema BK, Kwakman PH, Kamp N, El Ghalbzouri A, Lohner K, Zaat SA, Drijfhout JW, Nibbering PH. The antimicrobial peptide SAAP-148 combats drug-resistant bacteria and biofilms. Science Translational Medicine. January 2018, s. eaan4044. DOI 10.1126/scitranslmed.aan4044. PMID 29321257.
- ↑ a b Rendon A, Schäkel K. Psoriasis Pathogenesis and Treatment. International Journal of Molecular Sciences. March 2019, s. 1475. DOI 10.3390/ijms20061475. PMID 30909615.
Literatura
- Dürr UH, Sudheendra US, Ramamoorthy A. LL-37, the only human member of the cathelicidin family of antimicrobial peptides. Biochimica et Biophysica Acta (BBA) - Biomembranes. September 2006, s. 1408–25. DOI 10.1016/j.bbamem.2006.03.030. PMID 16716248.
- Chromek M, Slamová Z, Bergman P, Kovács L, Podracká L, Ehrén I, Hökfelt T, Gudmundsson GH, Gallo RL, Agerberth B, Brauner A. The antimicrobial peptide cathelicidin protects the urinary tract against invasive bacterial infection. Nature Medicine. June 2006, s. 636–41. DOI 10.1038/nm1407. PMID 16751768. S2CID 20704807.
- Gombart AF, Borregaard N, Koeffler HP. Human cathelicidin antimicrobial peptide (CAMP) gene is a direct target of the vitamin D receptor and is strongly up-regulated in myeloid cells by 1,25-dihydroxyvitamin D3. FASEB Journal. July 2005, s. 1067–77. DOI 10.1096/fj.04-3284com. PMID 15985530. S2CID 7563259.
- López-García B, Lee PH, Gallo RL. Expression and potential function of cathelicidin antimicrobial peptides in dermatophytosis and tinea versicolor. The Journal of Antimicrobial Chemotherapy. May 2006, s. 877–82. DOI 10.1093/jac/dkl078. PMID 16556635.
- Lehrer RI, Ganz T. Cathelicidins: a family of endogenous antimicrobial peptides. Current Opinion in Hematology. January 2002, s. 18–22. DOI 10.1097/00062752-200201000-00004. PMID 11753073. S2CID 23575052.
- Niyonsaba F, Hirata M, Ogawa H, Nagaoka I. Epithelial cell-derived antibacterial peptides human beta-defensins and cathelicidin: multifunctional activities on mast cells. Current Drug Targets. Inflammation and Allergy. September 2003, s. 224–31. DOI 10.2174/1568010033484115. PMID 14561157.
- van Wetering S, Tjabringa GS, Hiemstra PS. Interactions between neutrophil-derived antimicrobial peptides and airway epithelial cells. Journal of Leukocyte Biology. April 2005, s. 444–50. DOI 10.1189/jlb.0604367. PMID 15591123. S2CID 8261526.
- Agerberth B, Gunne H, Odeberg J, Kogner P, Boman HG, Gudmundsson GH. FALL-39, a putative human peptide antibiotic, is cysteine-free and expressed in bone marrow and testis. Proceedings of the National Academy of Sciences of the United States of America. January 1995, s. 195–9. DOI 10.1073/pnas.92.1.195. PMID 7529412. Bibcode 1995PNAS...92..195A.
- Cowland JB, Johnsen AH, Borregaard N. hCAP-18, a cathelin/pro-bactenecin-like protein of human neutrophil specific granules. FEBS Letters. July 1995, s. 173–6. DOI 10.1016/0014-5793(95)00634-L. PMID 7615076. S2CID 3172761.
- Gudmundsson GH, Magnusson KP, Chowdhary BP, Johansson M, Andersson L, Boman HG. Structure of the gene for porcine peptide antibiotic PR-39, a cathelin gene family member: comparative mapping of the locus for the human peptide antibiotic FALL-39. Proceedings of the National Academy of Sciences of the United States of America. July 1995, s. 7085–9. DOI 10.1073/pnas.92.15.7085. PMID 7624374. Bibcode 1995PNAS...92.7085G.
- Larrick JW, Hirata M, Balint RF, Lee J, Zhong J, Wright SC. Human CAP18: a novel antimicrobial lipopolysaccharide-binding protein. Infection and Immunity. April 1995, s. 1291–7. DOI 10.1128/IAI.63.4.1291-1297.1995. PMID 7890387.
- Gudmundsson GH, Agerberth B, Odeberg J, Bergman T, Olsson B, Salcedo R. The human gene FALL39 and processing of the cathelin precursor to the antibacterial peptide LL-37 in granulocytes. European Journal of Biochemistry. June 1996, s. 325–32. DOI 10.1111/j.1432-1033.1996.0325z.x. PMID 8681941.
- Larrick JW, Lee J, Ma S, Li X, Francke U, Wright SC, Balint RF. Structural, functional analysis and localization of the human CAP18 gene. FEBS Letters. November 1996, s. 74–80. DOI 10.1016/S0014-5793(96)01199-4. PMID 8946956. S2CID 35329283.
- Frohm M, Agerberth B, Ahangari G, Stâhle-Bäckdahl M, Lidén S, Wigzell H, Gudmundsson GH. The expression of the gene coding for the antibacterial peptide LL-37 is induced in human keratinocytes during inflammatory disorders. The Journal of Biological Chemistry. June 1997, s. 15258–63. DOI 10.1074/jbc.272.24.15258. PMID 9182550.
- Bals R, Wang X, Zasloff M, Wilson JM. The peptide antibiotic LL-37/hCAP-18 is expressed in epithelia of the human lung where it has broad antimicrobial activity at the airway surface. Proceedings of the National Academy of Sciences of the United States of America. August 1998, s. 9541–6. DOI 10.1073/pnas.95.16.9541. PMID 9689116. Bibcode 1998PNAS...95.9541B.
- Chen Q, Schmidt AP, Anderson GM, Wang JM, Wooters J, Oppenheim JJ, Chertov O. LL-37, the neutrophil granule- and epithelial cell-derived cathelicidin, utilizes formyl peptide receptor-like 1 (FPRL1) as a receptor to chemoattract human peripheral blood neutrophils, monocytes, and T cells. The Journal of Experimental Medicine. October 2000, s. 1069–74. DOI 10.1084/jem.192.7.1069. PMID 11015447.
- Agerberth B, Charo J, Werr J, Olsson B, Idali F, Lindbom L, Kiessling R, Jörnvall H, Wigzell H, Gudmundsson GH. The human antimicrobial and chemotactic peptides LL-37 and alpha-defensins are expressed by specific lymphocyte and monocyte populations. Blood. November 2000, s. 3086–93. DOI 10.1182/blood.V96.9.3086. PMID 11049988.
- Bals R, Lang C, Weiner DJ, Vogelmeier C, Welsch U, Wilson JM. Rhesus monkey (Macaca mulatta) mucosal antimicrobial peptides are close homologues of human molecules. Clinical and Diagnostic Laboratory Immunology. March 2001, s. 370–5. DOI 10.1128/CDLI.8.2.370-375.2001. PMID 11238224.
- Nagaoka I, Hirota S, Niyonsaba F, Hirata M, Adachi Y, Tamura H, Heumann D. Cathelicidin family of antibacterial peptides CAP18 and CAP11 inhibit the expression of TNF-alpha by blocking the binding of LPS to CD14(+) cells. Journal of Immunology. September 2001, s. 3329–38. DOI 10.4049/jimmunol.167.6.3329. PMID 11544322.
- Hase K, Eckmann L, Leopard JD, Varki N, Kagnoff MF. Cell differentiation is a key determinant of cathelicidin LL-37/human cationic antimicrobial protein 18 expression by human colon epithelium. Infection and Immunity. February 2002, s. 953–63. DOI 10.1128/IAI.70.2.953-963.2002. PMID 11796631.
- Giuliani A, Pirri G, Nicoletto S. Antimicrobial peptides: an overview of a promising class of therapeutics. Cent. Eur. J. Biol.. 2007, s. 1–33. DOI 10.2478/s11535-007-0010-5.
- Burton MF, Steel PG. The chemistry and biology of LL-37. Natural Product Reports. December 2009, s. 1572–84. DOI 10.1039/b912533g. PMID 19936387.
Externí odkazy
Média použitá na této stránce
Autor: Piktel, E., Niemirowicz, K., Wnorowska, U. et al. The Role of Cathelicidin LL-37 in Cancer Development. Arch. Immunol. Ther. Exp. 64, 33–46 (2016). https://doi.org/10.1007/s00005-015-0359-5, Licence: CC BY 4.0
The pleiotropic properties of LL-37 in relation to the different cells and tissues
