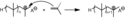Kationtová polymerizace
Kationtová polymerizace je druh polymerizační reakce, při které kationtový iniciátor přenáší náboj na monomer, který se tak stává reaktivním; tento monomer následně reaguje s ostatními monomery, čímž se utváří polymer.[1] [2]
Kationtová polymerace probíhá u alkenů s navázanými skupinamo dodávajícími elektrony a také u heterocyklických sloučenin. Podobně jako u aniontových adičních polymerizací je velmi citlivá na to, jaké rozpouštědlo se použije. Schopnost rozpouštědla tvořit volné ionty totiž určuje reaktivitu během kationtové propagační fáze.
Kationtová polymerace se využívá k výrobě polyisobutylenu a poly(N) (PVK).[3]
Monomery
Monomery podléhající kationtové polymerizaci mohou být dvojího typu: alkenové a heterocyklické monomery. U obou druhů monomerů reakce probíhá pouze tehdy, je-li výhodná z termodynamického hlediska; u alkenů totiž probíhá izomerizace na dvojné vazbě, u heterocyklů kvůli napětí cyklu a někdy také izomerizaci opakujících se jednotek. Monomery pro kationtovou polymerizaci jsou nukleofily a v průběhu reakce tvoří stabilní kationty.[4]
Alkeny
Kationtová polymerace probíhá u těch alkenů, které mají substituenty dodávající elektrony; tyto skupiny udělají z alkenu dostatečně silný nukleofil na to, aby atakoval elektrofilní iniciátory narůstání polymerového řetězce a zároveň musí být schopné stabilizovat vznikající elektrický náboj kationtu pro další průběh reakce. Níže jsou zobrazeny některé alkenové monomery sestupně podle své reaktivity; skupiny obsahující heteroatom vyvolávají vyšší reaktiitu než alkylové a arylové skupiny. Reaktivita karbeniového iontu je opačná oproti reaktivitě monomeru.[4]

Heterocyklické monomery

Heterocyklické sloučeniny polymerizovatelné kationtovou polymerizací jsou laktony, laktamy a cyklocké aminy. Při adici iniciátoru z cyklických monomerů vznikají lineární polymery. Na reaktivitu heterocyklických monomerů má vliv výše napětí v cyklu. Monomery s vysokým napětím cyklu, jako je například oxiran, jsou reaktivnější než 1,3-dioxepany, u kterých je toto napětí výrazně menší. Cykly obsahující šest nebo více atomů se polymerizují hůře, jelikož mají nižší kruhové napětí.[5]
Průběh reakce
Iniciace a iniciátory
Prvním krokem kationtové polymerace je iniciace. Během ní se vytvoří karbeniový ion. Druhý ion by neměl být nukleofilní, protože by pak došlo k samovolné terminaci reakce. Lze použít mnoho různých iniciátorů, u některých z nich je k provedení reakce nutná přítomnost koiniciátoru.[6]
Protické kyseliny
Jako iniciátory kationtové polymerizace lze použít silné protické kyseliny. K vytvoření dostatečného množství kationtů je potřeba vysoká koncentrace kyseliny. Vytvořený protiion (A−) musí být slabě nukleofilní, aby se zabránilo předčasné terminaci reakcí s protonovaným alkenem.[4] Běžně se používají kyselina fosforečná, sírová a fluor- a trifluormethansulfonová Při použití těchto iniciátorů vznikají pouze polymery s malou molekulovou hmotností.[1]

Lewisovy kyseliny/Friedelovy-Craftsovy katalyzátory
Lewisovy kyseliny jsou nejčastěji používanými katalyzátory kationtových polymerací. Nejvíce se používají chlorid cíničitý (SnCl4), chlorid hlinitý (AlCl3)>, fluorid boritý (BF3) a chlorid titaničitý (TiCl4). I když samotné Lewisovy kyseliny mohou vyvolat polymeraci, takreakce probíhá mnohem rychleji s vhodným zdrojhem kationtů, tím může být voda nebo alkoholy nebo i zdroj karbokationtů jako jsou anhydridy karboxylových kyselin a estery. Při takovýchto reakcích je zdroj kationtů iniciátor a Lewisova kyselina je koiniciátor. Při reakci iniciátoru s koiniciátorem vzniká komplex, který následně reaguje s monomerem. Protiion vytvořený tímto komplexem je mnohem méně nukleofilní než protiion A− vytvořený Brønstedovou–Lowryho kyselinou. Po přidání Lewisovy kyseliny mohou kationtovou polymerizaci iniciovat i halogeny.[1]

Soli karbeniových iontů
Soli stabilních karbeniových iontů lze použít jako iniciátory kationtové polymerizace pouze u několika nejreaktivnějších alkenů. Tyto iniciátory jsou nejčastěji používanými při studiích reakční kinetiky, protože lze snadno měřit pokles jejich absorbance. Nejčastěji se používají tritylový a tropyliový kation.
Ionizující záření
Ionizující záření může vytvořit dvojici radikál-kation, která může následně reakcí s monomerem zahájit kationtovou polymerizaci. Ovládání takových reakcí je obtížné a často závisí na druhu monomeru a podmínkách reakce. Často zde dochází ke tvorbě radikálů a aniontů.[4]

Propagace
Propagace probíhá adicí monomeru na aktivní látku, což bývá například karbeniový ion. Kationtová skupina na konci rostoucího řetězce se neustále obnovuje, což umožňuje adici dalších molekul monomeru.[5]

Vliv teploty
Rychlost propagace kationtové polymerace je ovlivňována teplotou reakční soustavy. Celková aktivační energie polymerace () je ovlivněna aktivačními energiemi iniciace (), propagace () a terminace ():
Obecně platí, že je větší než součet a , celková aktivační energie je tedy záporná, což znamená, že rychlost propagace roste s klesající teplotou. Nárůst rychlosti propagace s nárůstem teploty by probíhal při kladné celkové aktivační energii.[5]
Teplota má také vliv na délku vznikajícího řetězce. Nízké reakční teploty, kolem 170 až 190 K, vedou ke tvorbě delších řetězců,[5] což je důsledkem skutečnosti, že aktivační energie terminace a ostatních vedlejších reakcí jsou větší než aktivační energie propagace.[4][5]
Vliv rozpouštědla a protiiontu
Volba rozpouštědla, stejně jako vznikající protiiont, mají na kationtovou polymerizaci velký vliv. Karbeniový ion a protiion mohou být spojeny různými způsoby: může jít o kovalentní vazbu, těsný a tedy neoddělitelný, iontový pár, iontový pár (částečně) oddělený rozpouštědlem i o volné (zcela disociované) ionty.[1][5]
Spojení je nejsilnější v případě kovalentní vazby a nejslabší u volných iontů.[5] Při kationtové polymeraci se ionty dostávají do rovnováhy mezi iontovým párem a volnými ionty.[1] Čím polárnější je použité rozpouštědlo, tím lepší je solvatace a oddělení iontů. Jelikož jsou volné ionty reaktivnější než iontové páry, tak propagace kationtové polymerace probíhá bv polárnějších rozpouštědlech rychleji.[5][7]
Vliv má také velikost protiiontu. Menší protiion, s větší hustotou elektrického náboje, bude mít s karbeniovým iontem silnější elektrostatické působení než větší protiion s menší hustotou elektrického náboje.[1] Menší protiionty jsou rovněž snadněji solvatovány polárními rozpouštědly, což vede k rychlejšímu průběhu propagace.[5]
Terminace
Terminace obvykle probíhá jednomolekulárním přesmykem s protiiontem. Aniontová část protiiontu přitom reaguje s koncem prodlužujícího se řetězce.[1][5]

Přesun řetězce
Přesun řetězce může probíhat dvěma způsoby; jedním je přesun vodíku z konce aktivního řetězce na protiion.[5][7][8] V tomto případě dojde k ukončení prodlužování řetězce, ale komplex iniciátoru a koiniciátoru je obnoven a může se zúčastnit dalších iniciací.[4][5]

Druhou možností je přesun vodíku z konce aktivního řetězce na monomer. Tím se ukončuje prodlužování řetězce a také dochází k tvorbě nového aktivního komplexu karbeniového iontu s protiiontem, který se může účastnit další propagace.[5]

Použití
Kationtová polymerizace se nejvíce využívá na výrobu polyisobutylenových produktů, jako jsou polybuten a butylový kaučuk. Tyto polymery se využívají například jako lepidla. Reakční podmínky výroby každé z těchto látek jsou odlišné v záležitosti na požadované molekulové hmotnosti a konkrétním použitém monomeru. Při výrobě polyisobutylenu s nižší molekulovou hmotností (5–10.104 Da) se jako iniciátory používají AlCl3, BF3 nebo TiCl4 a reakce probíhá při teplotách −40 až 10 °C.[1] Tyto polymery se používají jako tmely.[1] Polyisobutyleny s větší molekulovou hmotností se vyrábějí za teplot −100 až −90 °C v chlormethanu.[4] Tyto polymery slouží jako kaučuky a přídavné látky do různých termoplastů.

Butylový kaučuk je, na rozdíl od polyisobutylenu, kopolymer, při jehož výrobě se společně polymerují isobuten (~98 %) a isopren (2 %). Jeho výroba probíhá jako nepřetržitý proces, přičemž iniciátorem je AlCl3.
Polybuten je jiný polymer, který obsahuje 80 % isobutenu and 20 % ostatných izomerů butenu, jako je but-1-en. Výroba těchto polymerů s nižší molekulovou hmotností (300 až 2 500 Da) probíhá za velkého rozmezí teplot (−45 až 80 °C) za přítomnosti AlCl3 nebo BF3. V závislosti na své molekulové hmotnosti se tyto polymery mohou používat mimo jiné jako lepidla, tmely a plastifikátory.
Další látky získatelné kationtovou polymerizací jsou homopolymery a kopolymery terpenů, jako například pinenů, které se používají jako lepidla.
Heterocyklické sloučeniny, například 1,3,5-trioxan, se polymerují společně s malými množstvími ethylenoxidu za vzniku krystalických polyoxymethylenových plastů.
Homopolymerizace alkylvinyletherů lze dosáhnout pouze skrz kationtovou polymerizaci.[1]
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Cationic polymerization na anglické Wikipedii.
- ↑ a b c d e f g h i j George Odian. Principles of Polymerization. Hoboken, NJ: Wiley-Interscience, 2004. (4). Dostupné online. ISBN 978-0-471-27400-1. S. 5–23.
- ↑ Herman F. Mark; Norbert Bikales; Charles G. Overberger; Georg Menges; Jacqueline I. Kroschwitz. Encyclopedia of Polymer Science and Engineering. Hoboken, NJ: Wiley-Interscience, 1990. (2). ISBN 978-0-471-80950-0.
- ↑ Douglas R. Robello. Chem 421: Introduction to Polymer Chemistry – Cationic Polymerization [online]. 2002 [cit. 2011-03-20]. Dostupné v archivu pořízeném z originálu dne 2011-07-20. (anglicky)
- ↑ a b c d e f g Krzysztof Matyjaszewski. Cationic Polymerizations: Mechanisms, Synthesis, and Applications. New York: Marcel Dekker, Inc, 1996. Dostupné online. ISBN 978-0-8247-9463-7.
- ↑ a b c d e f g h i j k l m John M. G. Cowie; Valeria Arrighi. Polymers Chemistry and Physics of Modern Materials. Boca Raton: Taylor & Francis, 2008. ISBN 978-0-8493-9813-1.
- ↑ J. P. Kennedy; E. Marechal. Chemistry of Initiation in Carbocationic Polymerization. Journal of Polymer Science: Macromolecular Reviews. 1981, s. 123–198.
- ↑ a b A. Raave. Principles of Polymer Chemistry. New York: Kluwer Academic/Plenum Publishers, 2000. (2). Dostupné online. ISBN 978-0-306-46368-6.
- ↑ Bradley D. Fahlman. Materials Chemistry. [s.l.]: Springer, 2008. ISBN 978-1-4020-6119-6.
Média použitá na této stránce
Autor: MatChem121, Licence: CC BY 3.0
Ionizing radiation initiation for cationic polymerization
Autor: MatChem121, Licence: CC BY 3.0
heterocyclic monomers for cationic polymerization
Autor: MatChem121, Licence: CC BY 3.0
Chain transfer with counter ion