Komplexy přechodných kovů s alkeny
Komplexy přechodných kovů s alkeny jsou komplexní sloučeniny obsahující jeden nebo více alkenových ligandů. Vyskytují se jako meziprodukty některých katalytických reakcí, při kterých se alkeny mění na jiné organické sloučeniny.[1]
Ve stabilních komplexech se obvykle objevují mono- a dialkeny.
Monoalkeny
Nejjednodušším monoalkenem je ethen. Je od něho odvozen velký počet komplexů, například Zeiseho sůl, dimer chlorobis(ethylen)rhodia (Rh2Cl2(C2H4)4), Cp*2Ti(C2H4) a homoleptický Ni(C2H4)3. K substituovaným monoalkenům patří cyklický cyklookten, vyskytující se mimo jiné v dimeru chlorobis(cyklookten)rhodia. Alkeny obsahující skupiny odtahující elektrony se silně vážou na kovy v nízkých oxidačních číslech; jako příklady zde mohou být uvedeny tetrakyanoethylen (TCNE), tetrafluorethylen, maleinanhydrid a estery kyseliny fumarové. Tvoří adukty s řadou kovů v oxidačním čísle 0.[1]
Dieny, trieny, polyeny, ketoalkeny a ostatní složitější alkenové ligandy
Butadien, cyklookta-1,5-dien a norbornadien patří mezi dobře prozkoumaná chelatační činidla. Na kovy se prostřednictvím několika uhlíkových center mohou také vázat trieny i některé tetraeny; k takovým ligandům patří například cykloheptatrien a cyklooktatetraen. Příslušné vazby se často popisují pomocí hapticity. Ketoalkeny jsou tetrahaptoligandy a stabilizují vysoce nenasycené nízkovalentní kovy, například u trikarbonylu (benzylidenaceton)železa a tris(dibenzylidenaceton)dipalladia.
- Komplexy kovů s alkeny
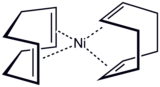
- Bis(cyklooktadien)nikl, používaný jako katalyzátor
- První známý komplex alkenu, anion Zeiseho soli.
- chlorobis(cyklookten)rhodia, zdroj RhCl.
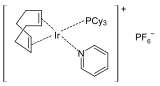
- Crabtreeův katalyzátor, vysoce aktivní katalyzátor hydrogenace
- Trikarbonyl (benzylidenaceton)železa, zdroj Fe(CO)3.
- [[Et3P]2Pt]6(η2:η2:η2:η2:η2:η2-C60), komplex fullerenu
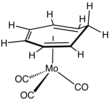
- Mo(C7H8)(CO)3, komplex cykloheptatrienu
- Biscyklooktatetraenželezo (Fe(C8H8)2), komplex cyklooktatetraenu
- Tetrakarbonyl (norbornadien)molybdenu, zdroj Mo(CO)4
- (Xylylen)Fe(CO)3, příklad stabilizace nestabilního alkenu komplexací
Struktura
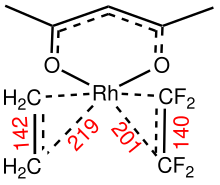
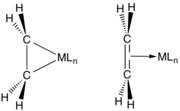
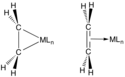
Vazby mezi alkeny a přechodnými kovy se popisují Dewarovým–Chattovým–Duncansonovým modelem, ve kterém se objevuje dodávání elektronů π orbitalů alkenu do prázdných orbitalů kovu. Tuto interakci podporuje sdílení elektronů s protivazebnými orbitaly alkenu. Rané kovy v nízkých oxidačních číslech (například TiII, ZrII a NbIII) jsou silné pí donory a jejich alkenové komplexy se často popisují jako metalocyklopropany. Reakcemi těchto sloučenin s kyselinami vznikají příslušné alkany. Pozdější kovy (IrI, Pt2), jež jsou slabšími pí donory, interagují s alkeny podobně jako Lewisovy kyseliny s Lewisovými zásadami. Obdobně je C2F4 lepším pí akceptorem než C2H4, což se projevuje na délkách vazeb kov-uhlík.[2]
- Bonding images
- Orbitalové interakce u komplexů kovů s ethenem podle Dewarova–Chattova–Duncansonova modelu
- Dvojice krajních zobrazení interakcí M---C2H4
Rotační bariéry
Bariéry rotace alkenů kolem vektoru vycházejícího z atomu kovu lze považovat za ukazatele síly vazeb kov-alken. K analýze těchto rotačních bariér jsou vhodné komplexy s nízkou symetrií. U CpRh(C2H4)(C2F4) je rotační bariéra ethenového ligandu přibližně 50 kJ/mol; u vazby Rh-C2F4 nebyla žádná rotace pozorována.[3]
Reakce a použití
Alkenové ligandy po vzniku komplexu ztrácejí většinu vlastností vyplývajících z přítomnosti dvojných vazeb. Při mezimolekulárním ataku alkylovými a hydridovými ligandy dochází k tvorbě nových alkylových komplexů. Kationtové komplexy alkenů mohou být atakovány nukleofily.[1]
Katalýza
Komplexy kovů a alkenů jsou mnoha reakcí alkenů katalyzovaných přechodnými kovy; patří sem Zieglerovy–Nattovy katalyzátory u polymerizací, hydrogenace, hydroformylace a řada dalších reakcí.[4]

Oddělování alkanů
Protože se alkeny většinou vytváří ve směsích s alkany, tak je důležité je od sebe oddělit. Příslušné postupy jsou často založené na transportních membránách obsahujících stříbrné nebo měďné soli, které se vratně navazují na alkeny.[5]
Při argentační chromatografii se k analýze organických sloučenin podle počtu a druhu alkenových skupin používají stacionární fáze obsahující stříbrné soli. Tento postup se často používá při analýze nenasycených složek tuků a mastných kyselin.[6]
Výskyt
Komplexy kovů a alkenů jsou v přírodě vzácné; výjimku tvoří případ, kdy ethen ovlivňuje zrání ovoce navázáním na měďné centrum transkripčního faktoru.[7]
Reference
V tomto článku byl použit překlad textu z článku Transition metal alkene complex na anglické Wikipedii.
- ↑ a b c Elschenbroich, C. ”Organometallics” (2006) Wiley-VCH: Weinheim ISBN 3-527-29390-6
- ↑ a b J. A. Evans; D. R. Russell. The Crystal Structures of Ethylene and Tetrafluoroethylene Complexes of Rhodium(I). Journal of the Chemical Society D: Chemical Communications. 1971, s. 197. DOI 10.1039/C29710000197.
- ↑ Richard Cramer; Jules B. Kline; John D. Roberts. Bond Character and Conformational Equilibration of Ethylene- and Tetrafluoroethylenerhodium Complexes from Nuclear Magnetic Resonance Spectra. Journal of the American Chemical Society. 1969, s. 2519–2524. DOI 10.1021/ja01038a021.
- ↑ Piet W. N. M. van Leeuwen "Homogeneous Catalysis: Understanding the Art", 2004, Wiley-VCH, Weinheim. ISBN 1-4020-2000-7
- ↑ Maryam Azhin; Tahereh Kaghazchi; Mohammad Rahmani. Review on Olefin/Paraffin Separation Using Reversible Chemical Complexation technology. Journal of Industrial and Engineering Chemistry. 2008, s. 622–638. DOI 10.1016/j.jiec.2008.04.014.
- ↑ Boryana Nikolova-Damyanova. Principles of Silver Ion Complexation with Double Bonds [online]. Dostupné online.
- ↑ Jose M. Alonso, Anna N. Stepanova "The Ethylene Signaling Pathway" Science 2004, Vol. 306, pp. 1513-1515. DOI:10.1126/science.1104812
Média použitá na této stránce
Autor: Smokefoot, Licence: CC BY-SA 4.0
chemical structure of cycloheptatrienemolybdenum tricarbonyl
bis(cyclooctatetraene)iron(0)
(benzylideneacetone)iron-tricarbonyl-2D-skeletal
structure of XylyleneFe(CO)3
structure of (acac)Rh(C2H4)(C2F4), distance (red) in picometers.
chemical structure of Crabtree's catalyst



![[[Et3P]2Pt]6(η2:η2:η2:η2:η2:η2-C60), komplex fullerenu](http://upload.wikimedia.org/wikipedia/commons/thumb/a/ae/Fullerene_4.png/126px-Fullerene_4.png)