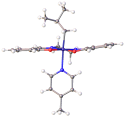
Komplexy salenu s kovy
Komplexy salenu s kovy jsou komplexní sloučeniny tvořené kationty kovů a ligandy odvozenými od N,N'-bis(salicyliden)ethylendiaminu, běžně nazývaného salen. Příkladem takové sloučeniny může být salkomin, komplex kobaltnatého kationtu (Co2+), jehož vzorec se často zkracuje na Co(salen).[1] Tyto komplexy se zkoumají jako možné katalyzátory.[2][3]

V molekule salenu (H2salen nebo salenH2) se nachází dva fenolové hydroxyly. Ligandem je obvykle jeho konjugovaná zásada (salen2−), která vzniká odtržením protonů z těchto hydroxylů. Atom kovu zpravidla vytváří čtyři koordinačně-kovalentní vazby, dvě s kyslíkovými a dvě s dusíkovými atomy.
Příprava
Salen vytváří komplexy s většinou přechodných kovů. Tyto komplexy se připravují reakcí H2salenu s příslušnými alkoxidy, amidy nebo octany. Lze také využít reakci s halogenidem, za přítomnosti nebo bez přítomnosti zásady; před reakcí s halogenidem lze provést deprotonaci nenukleofilní zásadou, jako je hydrid sodný. Jako příklad je možné uvést Jacobsenův katalyzátor, který se připravuje reakcí salenu s octanem manganatým.[4]
Struktura

Komplexy salenu s ionty d8 kovů, jako je Ni(salen), mají většinou nízkospinovou čtvercovou geometrii.
Komplexy s jinými kovy mohou mít další ligandy nad rovinou určenou dusíkovými a kyslíkovými atomy v molekule salenu. Komplexy s jedním ligandem navíc, například VO(salen), mívají čtvercově pyramidální geometrii. Komplexy s dvěma ligandy navíc, jako je Co(salen)Cl(py), mají obvykle oktaedrickou geometrii. MN2O2 jádro zpravidla mívá rovinný nebo téměř rovinný tvar, i když je ethylenový můstek zakřivený a ligand jako celek zaujímá pokřivenou grupu symetrie C2. Jsou známy případy, kdy ligandy způsobily posun N2O2 donorů mimo rovinu molekuly.[6]
Reakce

První komplexy salenu s kovy byly objeveny v roce 1938. Následně bylo zjištěno, že komplex Co(salen) na sebe zvratně váže molekulární kyslík (O2), což vedlo k výzkumu schopností komplexních sloučenin salenu a jiných ligandů s kobaltem na sebe vázat a následně přepravovat kyslík, za účelem přípravy umělých přenašečů kyslíku.[1]
Komplexy salenu a kobaltu také mají některé vlastnosti podobné jako vitamín B12.[7]
Homogenní katalýza
Při asymetrické epoxidaci alkenů se používají katalyzátory obsahující mangan. Pomocí hydrolytického kintického rozdělení lze rozdělit racemické směsi epoxidů selektivní hydrolýzou jednoho enantiomeru, kdy se jako katalyzátor používá obdobný kobaltitý komplex.[8]
Chromité a kobaltité komplexy salenu jsou dobrými katalyzátory při přípravě polykarbonátů z oxidu uhličitého a epoxidů.[9]
Podobné komplexy

Komplexy substituovaných salenů
Nesubstituované salenové komplexy se špatně rozpouštějí v organických rozpouštědlech. Rozpustnost lze zvýšit pomocí nepolární skupiny připojené na ethylenový můstek nebo na benzenové jádro; příkladem je salpn, který vznikne, když se salicylaldehydem místo ethylendiaminu reaguje 1,2-diaminopropan. Takto vzniklý produkt se používá jako aditivum do motorových olejů a paliv, kde zachytává ionty kovů.
Přítomnost větších skupin v blízkosti koordinačního centra zvyšuje katalytickou aktivitu a znesnadňuje dimerizaci, a proto je žádoucí. Ligandy odvozené od 3,5-di-terc-butylsalicylaldehydu mají obě tyto vlastnosti a navíc jsou dobře rozpustné i v nepolárních rozpouštědlech jako je pentan.
Chirální salenové ligandy lze připravit substitucí diaminového můstku, benzenového jádra, nebo obou těchto částí molekuly.[10] Jako příklad lze uvést kondenzaci C2 symetrického trans-1,2-diaminocyklohexanu s 3,5-di-terc-butylsalicylaldehydem, při níž vzniká ligand, který vytváří s chromem, manganem, kobaltem a hliníkem komplexy používané jako katalyzátory asymetrických reakcí, mezi které patří mimo jiné Jacobsenova epoxidace, katalyzovaná komplexem salen-Mn.[4]
Komplexy s ligandy podobnými salenu
Komplexy s ligandy podobnými salenu se připravují z ligandů s podbnými chelatačními skupinami, jako jsou acacen, salph a salqu. U komplexů mědi a salqu bylo zkoumáno jejich možné využití jako katalyzátorů oxidačních reakcí.[11]
Komplexy se salanovými ligandy
Komplexní sloučeniny, ve kterých jako ligandy slouží salan nebo salalen, které mají jednu nebo dvě nasycené vazby dusík-aryl (tedy aminové namísto iminových) mají oproti odpovídajícím salenovým komplexům větší elektronovou hustotu na kovovém centru.[12][13]
Reference
V tomto článku byl použit překlad textu z článku Metal salen complexes na anglické Wikipedii.
- ↑ a b T. Tsumaki. Nebenvalenzringverbindungen. IV. Über einige innerkomplexe Kobaltsalze der Oxyaldimine. Bulletin of the Chemical Society of Japan. 1938, s. 252–260.
- ↑ Carlos Baleizão; Hermenegildo Garcia. Chiral Salen Complexes: An Overview to Recoverable and Reusable Homogeneous and Heterogeneous Catalysts. Chemical Reviews. 2006, s. 3987–4043. PMID 3987–4043 16967927 3987–4043.
- ↑ Antonello Decortes; Ana M. Castilla; Arjan W. Kleij. Salen-Complex-Mediated Formation of Cyclic Carbonates by Cycloaddition of CO2 to Epoxides. Angewandte Chemie International Edition. 2010, s. 9822–9837. PMID 20957709.
- ↑ a b LARROW, J. F.; JACOBSEN, E. N. (R,R)-N,N'-Bis(3,5-Di-tert-Butylsalicylidene)-1,2-Cyclohexanediamino Manganese(III) Chloride, A Highly Enantioselective Epoxidation Catalyst. Org. Synth.. 2004. Dostupné online. (anglicky); Coll. Vol.. S. 96. (anglicky)
- ↑ P. Coggon; A. T. McPhail; F. E. Mabbs; A. Richards; A. S. Thornley. Preparation, Magnetic, and Electronic Spectral Properties of Some Chromium(III)–NN′-Ethylenebis(salicylideneiminato) Complexes: Crystal and Molecular Structure of N,N′-Ethylenebis(salicylideneiminato)diaquochromium(III) Chloride. Journal of the Chemical Society A. 1970, s. 3296–3303.
- ↑ Randall B. Lauffer; Robert H. Heistand; Lawrence Que. Dioxygenase models. Crystal Structures of the 2,4-Pentanedionato, Phenanthrenesemiquinone, and Catecholato Complexes of N,N'-Ethylenebis(salicylideneaminato)iron(III). Inorganic Chemistry. 1983, s. 50–55.
- ↑ Chen Huilan; Han Deyan; Li Tian; Yan Hong; Tang Wenxia. Synthesis and Crystal Structure of Organocobalt(III) Complexes with Secondary Alkyls or Bulky Schiff Base Equatorial Ligands. Inorganic Chemistry. 1996, s. 1502–1508.
- ↑ Makoto Tokunaga; Jay F. Larrow; Fumitoshi Kakiuchi; Eric N. Jacobsen. Asymmetric Catalysis with Water: Efficient Kinetic Resolution of Terminal Epoxides by Means of Catalytic Hydrolysis. Science. 1997, s. 936–938. Dostupné online. PMID 9252321.
- ↑ D. J. Darensbourg. Making Plastics from Carbon Dioxide: Salen Metal Complexes as Catalysts for the Production of Polycarbonates from Epoxides and CO2. Chemical Reviews. 2007, s. 2388–2410. PMID 17447821.
- ↑ Pier Giorgio Cozzi. Metal-Salen Schiff base complexes in catalysis: Practical aspects. Chemical Society Reviews. 2004, s. 410–421. PMID 15354222.
- ↑ Xianghong Wu; A. V. E. Gorden. 2-Quinoxalinol Salen Copper Complexes for Oxidation of Aryl Methylenes. European Journal of Organic Chemistry. 2009, s. 503–509.
- ↑ David A. Atwood; Michael P. Remington; Drew Rutherford. Use of the Salan Ligands to Form Bimetallic Aluminum Complexes. Organometallics. 1996, s. 4763.
- ↑ Albrecht Berkessel; Marc Brandenburg; Eva Leitterstorf; Julia Frey; Johann Lex; Mathias Schäfer. A Practical and Versatile Access to Dihydrosalen (Salalen) Ligands: Highly Enantioselective TitaniumIn Situ Catalysts for Asymmetric Epoxidation with Aqueous Hydrogen Peroxide. Adv. Synth. Catal.. 2007, s. 2385.
Média použitá na této stránce
Structural formula of the salpn ligand.
[Cr(salen)(aq)2]Cl from doi 10.1039/j19700003296
General structure of Salen metal complex.
Synthesis of (R,R)-Jacobsen's catalyst Hanson, John. (2001). "Synthesis and Use of Jacobsen's Catalyst: Enantioselective Epoxidation in the Introductory Organic Laboratory". J. Chem. Educ. 78: 1266.
Structure of Co(salen)(CH2CHMe2)(4-picoline) from doi 10.1021/ic940516h