Konformace
Konformace je ve stereochemii termín označující různá uspořádání molekul jedné sloučeniny; jedná konkrétní konformace se pak nazývá konformer (konformační izomer). Nejčastěji o ní mluvíme u uhlovodíkových (organických) sloučenin. Konformační variabilita je možná díky vnitřní rotaci částí molekul okolo jednoduchých vazeb, sloučeniny s dvojnou a trojnou vazbou kvůli přítomnosti π orbitalu tuto vlastnost ztrácejí. O konformacích můžeme mluvit pouze u molekul, které mají nejméně čtyři atomy, přičemž tři sousední nesmí ležet na jedné přímce.
Vlastnosti

Na rozdíl od konstitučních izomerů mezi sebou mohou konformery volně přecházet, proto je obvykle nemožné je izolovat. Přesto mezi jednotlivými konformery existuje energetická bariéra, kterou musí molekula překonat, takže se daná molekula vyskytuje procentuálně častěji v energeticky výhodné konformaci. Zvýšení energie v méně energeticky výhodné konformaci se nazývá torzní pnutí nebo Pitzerovo napětí.[1]
Jednotlivé konformery můžeme zobrazit perspektivním zobrazením, kde danou vazbu znázorňujeme šikmo, a nebo Newmanovou projekcí, kde molekulu sledujeme ve směru dané vazby.[1]
Konformace acyklických sloučenin
Nejjednodušší organickou molekulou, u které pozorujeme změny konformace kolem vazby uhlík-uhlík, je ethan. Při rotaci se vodíky obou methylových skupin mohou dostat do dvou hraničních stavů, zákrytové (souhlasné) a nezákrytové (střídavé). Střídavá konformace je u ethanu výhodnější asi o 12 kJ.mol−1 a za běžných podmínek se v ní vyskytuje 99 % jeho molekul. U propanu tento rozdíl činí přibližně 14 kJ.mol−1.[1]
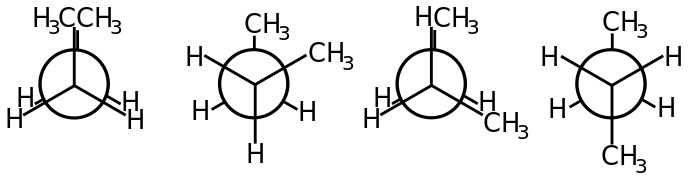
U butanu při otáčení na vazbě mezi 2. a 3. uhlíkem rozlišujeme více mezních konformací podle torzního úhlu mezi methylovými skupinami: antiperiplanární (180°), antiklinální (120°), synklinální (60°) a synperiplanární (0°). Nejnižší energii má přitom konformace antiperiplanární.[1]
- Zákrytová a nezákrytová konformace ethanu znázorněna Newmanovou projekcí
- Graf znázorňující relativní rozdíl energie ethanu v závislosti na konformaci
- Konformace butanu v Newmanově projekci
Konformace cyklických sloučenin
Nejjednodušším cyklickým uhlovodíkem, který může nabývat různých konformací, je cyklobutan. Aby vyrovnal úhlové a torzní pnutí, je pro něj energeticky nejvýhodnější, aby se jeden z uhlíků nacházel přibližně 25° nad rovinou ostatních tří. Podobně vystupuje i u cyklopentanu jeden z uhlíků mimo rovinu zbylých čtyř.[1]
Konformace cyklohexanu

Podle experimentů má cyklohexan oproti předpokladům nulové torzní a úhlové pnutí, na což v roce 1890 poskytl odpověď chemik Hermann Sachs a později ji rozvinul Ernst Mohr. Cyklohexan se totiž zpravidla nevyskytuje planárně, nýbrž zaujímá tzv. židličkovou konformaci, kde atomy uhlíků díky zaujaté struktuře nemusí překonávat prakticky žádný odpor.[1] Další mezní konformací, které se rozlišuje, ale není natolik energeticky výhodná (neobsahuje úhlové pnutí, ale je v ní přítomno značné pnutí torzní), je konformace tzv. vaničková. Konformací, kterou musí molekula zaujmout při přechodu mezi židličkovou a vaničkovou, je konformace zkřížená.[2]
I méně výhodné konformace cyklohexanu jsou fixovány jako součást některých složitějších polycyklických molekul: židličková v adamantanu, vaničková v bicyklo[2.2.2]oktanu a zkřížená v twistanu.[2]
U nejběžnější židličkové konformace rozlišujeme dva typy vazeb substituentů na cyklus (například vodíků). Z každého uhlíku totiž vychází jedna vazba axiální a jedna ekvatoriální, přičemž axiální vazby míří přibližně kolmo na aproximovanou rovinu molekuly, zatímco ekvatoriální leží přibližně v této rovině.[1]

U židličkové konformace cyklohexanu navíc může docházet k tzv. překlopení, kdy se jeden konformer samovolně změní ve svůj zrcadlový obraz a přitom dojde k prohození axiálních a ekvatoriálních vazeb (původně axiální vodíky se nyní nachází v ekvatoriální poloze a naopak). Bariéra tohoto přechodu je jen 45 kJ.mol−1 a dochází k němu velmi rychle, proto máme ve směsi přítomny obě formy a jednotlivé struktury nerozlišujeme.[1]
Odkazy
Reference
Externí odkazy
 Obrázky, zvuky či videa k tématu konformace na Wikimedia Commons
Obrázky, zvuky či videa k tématu konformace na Wikimedia Commons
Média použitá na této stránce
Eclipsed conformer
Chair_Boat_Conformers_Formulae
Two chair conformations of cyclohexane
Comments
Autor: Keministi, Licence: CC0
Newman projections of ethane conformations & their relative energy differences (not total energies). Conformations form when ethane rotates about one of its single covalent bond. Torsional/dihedral angle is shown on x-axis.
Conformations (according to IUPAC):
A: staggered
B: eclipsed
Valleys of the pink graph are conformations lowest in energy (shown as A). Peaks are conformations highest in energy (shown as B). B is highest & A lowest in energy. A is thus the most stable conformation.
Valleys are local energy minima. A can thus be classified as a rotamer (a class of conformers). Peaks are not rotamers, & are caused by repulsive forces of the hydrogens.
Source for conformation names & rotamer classification:
- Pure & Appl. Chem., Vol. 68, No. 12, pp. 2193-2222, 1996.
Source for the relative energy differences & other info in this description:
- McMurry JE (2003). Organic Chemistry. (8 ed.). Brooks Cole. p. 95. ISBN 9780840054449.
Autor: Bert.Kilanowski, Licence: CC0
The four conformations of butane shown as Newman projections.