Koordinační číslo
Pro určení struktury koordinační sloučeniny je důležitá znalost koordinačního čísla, což je počet σ vazeb mezi centrálním atomem a ligandy. Toto číslo odpovídá počtu ligandů pouze v případě jednovazných (monodentátních) ligandů. Hodnota koordinačního čísla běžných komplexů se pohybuje mezi dvěma a devíti, ale např. u lanthanoidů můžeme pozorovat i vyšší koordinační čísla.
Historie
Zakladatel oboru koordinační chemie je Alfred Werner, který roku 1893 vypracoval novou koncepci o chemických vazbách. Hlavní vazba (oxidační číslo) je vyrovnávána anionty a vedlejší vazba (dnes koordinační číslo), ve které mohou být jak anionty tak elektroneutrální částice a ve velmi vzácných případech i kationty. Jelikož v této době neexistovala rentgenostrukturní analýza, musela se stereochemie komplexů studovat výhradně chemickými metodami. Při studijních se vycházelo zejména z přípravy izomerů koordinačních sloučenin. Během dvaceti let bylo připraveno velké množství komplexů od nejrůznějších kovů a pomocí nich se určovalo, jaké prostorové uspořádání komplexy mají.
Základní informace
- Přechodné prvky uplatňují v komplexech koordinační čísla od 2 do 9. Z nich se nejvíce vyskytují čísla 4 a 6. Vyšší koordinační čísla, které již nepatří k běžným, se vyskytují u vnitřně přechodných prvků.
- Díky elektronovým efektům jako je Jahnův-Tellerův efekt jsou některá geometrická uspořádání stabilnější než jejich alternativy, např. pro některé sloučeniny je trigonální prisma výhodnější než oktaedrická struktura.
- Vliv na maximální koordinační číslo má elektronová konfigurace centrálního atomu, poměr velikostí ligandu a centrálního atomu, vliv náboje centrálního atomu a počet volných vazebných orbitalů centrálního atomu.
Některé ligandy mají vžité zkratky, které se ve vzorcích používají, jejich význam je uveden na stránce o Názvosloví koordinačních sloučenin.
Koordinační číslo 2
Toto číslo je známo pouze u komplexů Cu+, Ag+, Au+ a Hg2+, které mají plně zaplněné d-orbitaly. Struktura těchto komplexů je lineární. Typickým příkladem je kation diamminostříbrný [Ag(NH3)2]+, který je na obrázku.

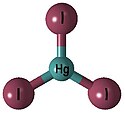
Koordinační číslo 3

Toto koordinační číslo je velmi vzácné. Tvar komplexu je rovnostranný trojúhelník. Je známé jen u některých komplexů s objemnými ligandy jako je například [Cu{SC(NH2)2}3]+. Z komplexů s jednoduššími ligandy je toto koordinační číslo známo pouze u trijodidortuťnatého aniontu [HgI3]− (na obrázku) v kombinaci s vhodným kationtem - SMe3[HgI3] má tvar rovnostranného trojúhelníku, ale NMe4[MeI3] polymeruje na koordinační číslo 4. Dalším příkladem koordinačního čísla 3 jsou komplexy s prostorově náročnými ligandy, které si toto koordinační číslo vynucují - [Fe{N(SiMe3)2}3], [Cu{SC(NH2)2}3] a [Cu(SPPH3)3]ClO4. U některých komplexů je toto koordinační číslo pouze zdánlivé - například [CuCl3]− je ve skutečnosti polymerní koordinační číslo 4.

Koordinační číslo 4

Toto koordinační číslo je druhé nejběžnější a odpovídá mu tetraedrické a čtvercové uspořádání koordinační sféry. Výběr mezi oběma geometriemi závisí do určité míry na elektronové konfiguraci centrálního atomu.
Jestliže jde o atom se sféricky symetrickou elektronovou konfigurací (elektrony jsou pravidelně uspořádány kolem jádra), pak se budou ligandy snažit uspořádat tak, aby byly co nejdále od sebe. Tomu odpovídá tetraedrické uspořádání. Tato situace nastává u komplexů s a p-prvků (např. [BF4]−) a u těch d-prvků, které buď dosáhly skupinového oxidačního čísla (všechny orbitaly prázdné, např. Mn+7 - MnO4−), nebo mají konfiguraci d5 příp. d10 (symetrické konfigurace, např. Fe+3, Cu+ - [Cu(py)4]+, Ni0 - [Ni(CO)4]).
Centrální atomy s jinou konfigurací budou preferovat čtvercové uspořádání komplexů. Platí to především pro konfiguraci d8 (Pd+2, Pt+2), která ve většině případů vede ke čtvercovému uspořádání (výjimku tvoří Ni2+, který tvoří běžně také tetraedrické komplexy). Čtvercové uspořádání ovšem vyžaduje alespoň jeden volný d orbital pro hybridizaci dsp2.
Jsou-li rozdíly v energii mezi čtvercovým a tetraedrickým uspořádáním malé (např. u některých komplexů Ni+2 nebo Cu+2), mohou existovat komplexy v obou geometriích nebo může mezi oběma docházet k vzájemné přeměně - (NH4)2[CuCl4] je čtvercový a Cs2[CuBr4] je přibližně tetraedrický. Čtverec a tetraedr jsou pak spíše extrémními možnostmi uspořádání ligandů a skutečný tvar leží někde mezi nimi. Tento jev se nazývá konformační izomerií a je o něm pojednáno níže.
Komplexy s koordinačním číslem 4 mají historický význam, protože se jich v počátcích koordinační chemie využívalo k důkazům stereochemie komplexů, založených na shodě v počtu předpovězených a experimentálně získaných izomerů. Komplex [Ma2b2] (a a b jsou různé jednovazné ligandy) má ve čtvercovém uspořádání izomery cis a trans, ale tetraedrické uspořádání žádné izomery nemá. Například komplex [Pt(NH3)2Cl2] byl připraven v podobě dvou izomerů, a proto se předpokládalo, že jde o čtvercové uspořádání. Co když ovšem nejde o izomerii cis a trans. Existuje i jiná izomerie a totiž konformační - jeden izomer by mohl být tetraedrický a druhý čtvercový. Dnes se již ovšem ví, že komplex [Pt(NH3)2Cl2] je čtvercový a jeho izomery jsou skutečně cis a trans.

Koordinační číslo 5

Koordinační číslo 5 bylo dříve považovalo za vzácné. Dnes jsou známy komplexy s tímto koordinačním číslem od všech centrálních atomů s konfigurací od d1 do d9. Tomuto koordinačnímu číslu odpovídají dvě mezní struktury – čtvercová pyramida ([VO(acac)3]) a trigonální bipyramida. Jelikož energie přeměny jedné limitní struktury v druhou je často malá, má většina komplexů strukturu odpovídající přechodu mezi oběma geometriemi. Mnohé sloučeniny s pětivazným centrálním atomem se chovají způsobem, který označujeme jako fluxionální. To znamená, že existují ve dvou nebo více chemicky ekvivalentních strukturách, které přecházejí jedna v druhou takovou rychlostí, že je nelze vzájemně rozlišit fyzikálním měřením. Často je závislé uspořádání ligandů na mřížkových silách - např. v komplexu [Cr(tn)3][Ni(CN)5] má aniont penta(kyanido)nikelnatý tvar čtvercové pyramidy a v komplexu [Cr(en)3][Ni(CN)5] tvar deformované trigonální bipyramidy. Obecně však platí, že podle teorie VSEPR jsou komplexy p-prvků trigonálně bipyramidní, až na malé výjimky.
Určitou výjimkou u tohoto koordinačního čísla jsou komplexy (především Ni+2 a Co+2) s tzv. „tripod“ ligandy, např. PCH2CH2PR2)3, které si svou strukturou vynucují jednoznačně tvar trigonální bipyramidy.

Koordinační číslo 6

Toto koordinační číslo je nejběžnější a odpovídá mu oktaedrické a trigonálně prizmatické uspořádání koordinační sféry. Komplexy jsou výhradně oktaedrické. Právě na těchto komplexech Alfred Werner obhajoval svou teorii o koordinačních sloučeninách a za rozštěpení komplexu [Co(Co(NH3)4(OH)2)] na optické antipody v roce 1914 získal Nobelovu cenu, protože tím naprosto jednoznačně dokázal pravdivost své teorie. Teprve roku 1923 byl popsán první případ trigonálně prizmatických komplexů - MoS2 a WS2, které mají polymerní strukturu - a roku 1965 se začaly objevovat i další trigonálně prizmatické komplexy jako např. [Re(S2C2Ph2)3].
V reálných komplexech je oktaedr vždy nějakým způsobem deformován. I pokud se jedná o komplex s homogenní koordinační sférou (např. šest stejných ligandů), dochází k deformacím vlivem tzv. Jahnova–Tellerova efektu. Ten je způsoben nerovnoměrným rozložením elektronů centrálního atomu.


Existují v podstatě tři typy deformací pravidelného oktaedru: protažení nebo stlačení ve směru dvou protilehlých vrcholů, protažení nebo stlačení ve směru dvou protilehlých stěn a vzájemná rotace dvou protilehlých stěn. Poslední deformace vede v krajním případě až k tvaru trigonální prizma.

Koordinační číslo 7
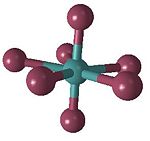
Tomuto koordinačnímu číslu odpovídají tři základní prostorová uspořádání: pentagonální bipyramida ([ZrF7]3− a [HfF7]3−) a trigonální prizma doplněné o vrchol ([NbF7]2− a [TaF7]2−) a oktaedr doplněný o vrchol ([NbF6O]) (sedmý ligand je umístěn nad některou ze stěn trigonálního prizmatu a oktaedru).
Podobně jako u všech dalších vyšších koordinačních čísel je rozdíl energií mezi těmito uspořádáními velmi malý a o konkrétním tvaru rozhodují především sterické požadavky ligandů.

Koordinační číslo 8

Nejpravidelnějším uspořádáním pro koordinační číslo 8 je krychle, přesto se s tímto tvarem u komplexů prakticky nesetkáme. Díky vzájemnému odpuzování ligandů dochází k deformacím krychle, které vedou na tvar dodekaedru ([ZrF8]4− a [Mo(CN)8]4−) nebo čtvercového antiprizmatu ([TaF8]3− a [ReF8]2−) (krychle s horní stěnou pootočenou o 45°). Rozdíl energií mezi těmito uspořádáními je velmi malý a o konkrétním tvaru rozhodují především sterické požadavky ligandů.

Koordinační číslo 9

Většina komplexů s tímto koordinačním číslem má tvar trojbokého hranolu (trigonálního prizmatu), kde nad každou ze tří svislých stěn je umístěn další ligand (na obrázku) ([ReH9]2−) (jde v podstatě o trigonální prizma, které má nad každou ze svých stěn ještě jeden ligand). Ke komplexům s tímto koordinačním číslem patří hydráty solí lanthanoidů ([M(H2O)9]3+). Další uspořádání, které bylo zjištěno má tvar čtvercového prizmatu s devátým ligandem umístěným nad jednu z jeho stěn - např. [{La(H2O)7Cl}2]4+. Existují i jiná uspořádání, ale mnohá z nich jsou velmi nepravidelná.

Koordinační čísla větší než 9
Tato koordinační čísla nejsou běžná a vyskytují se především u lehčích lanthanoidů a aktinoidů. Tedy u atomů s dostatečně velkým atomovým poloměrem. Navíc je nutné soudit, že k dosažení takto vysokých koordinačních čísel jsou nutné f-orbitaly. Jelikož je navíc v těchto komplexech převážně iontová vazba, je nutné, aby centrální atom měl dostatečně velký náboj pro přitažení tak velkého množství ligandů. Pro koordinační číslo 10 existuje komplex [La(H2O)4edta] a K4[Th(H2O)2(O2CCO2)4].2 H2O, pro koordinační číslo 11 [La(dapbah)(NO3)3], pro koordinační číslo 12 [Ce(NO3)6]3−. Vyšší koordinační čísla již nejsou ani mezi lanthanoidy a aktinoidy častá, ale vyskytují až do koordinačního čísla 16 zvláště mezi organokovovými sloučeninami a hydroboráty.
Související články
- Koordinační chemie
- Ligand
- Centrální atom
- Koordinační vazba
- Komplexní sloučenina
- Izomerie koordinačních sloučenin
- Barevnost komplexů
- Stabilita komplexních sloučenin
- Magnetické vlastnosti koordinačních sloučenin
Literatura
- Dr. Heinrich Remy, Anorganická chemie 2. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 2. díl, 1. vydání 1993 ISBN 80-85427-38-9
- Jursík F.: Anorganická chemie kovů. 1. vyd. 2002. ISBN 80-7080-504-8 (elektronická verze)
Média použitá na této stránce
Tetragonální antiprizma
Chlorid fosforečný - PCl5
Autor: Václav Slovák, Licence: CC BY-SA 3.0
Čtvercová pyramida a trigonální bipyramida
Tetrafluoridoboritanový anion - [BF4]-
Autor: Václav Slovák, Licence: CC BY-SA 3.0
Okaedr a trigonální prizma
Tetrachloridoměďnatý anion
Polyedr
Hexafluoridoželezitý aniont - [FeF6]3-
Pentagonální bipyramida
Trijodidortuťnatý anion