Kuban
| Kuban | |
|---|---|
 | |
| Obecné | |
| Systematický název | pentacyklo[4.2.0.02,5.03,8.04,7]oktan |
| Triviální název | kuban |
| Anglický název | Cubane[1] |
| Sumární vzorec | C8H8 |
| Identifikace | |
| Registrační číslo CAS | 277-10-1 |
| PubChem | 136090 |
| Vlastnosti | |
| Molární hmotnost | 104,15 g/mol |
| Teplota tání | 131 °C |
| Hustota | 1,29 g/cm³ |
Některá data mohou pocházet z datové položky. | |
Kuban (C8H8) je syntetická uhlovodíková molekula, která je složena z osmi uhlíkových atomů uspořádaných do vrcholů krychle. Na každý atom uhlíku je navázán jeden atom vodíku. Jako krystalická pevná látka patří mezi Platónské uhlovodíky. Ty byly poprvé syntetizovány v roce 1964 profesorem chemie na Chicagské univerzitě Philipem Eatonem.[2]
Vlastnosti kubanu
Před publikací Eatonovy a Coleovy práce byli vědci přesvědčeni, že kubické uhlíkové molekuly nemohou existovat, neboť neobvyklý pravý úhel mezi vazbami uhlíku by vedl k přílišnému napětí vazeb a tedy k jejich nestabilitě. Jednou vzniklý kuban je však kineticky stabilní díky absenci snadno dostupné dekompoziční cesty.
Kuban a jeho deriváty mají řadu užitečných vlastností. Pravý úhel mezi vazbami uhlíku znamená, že vazby jsou vysoce napjaté, u toho důvodu jsou sloučeniny kubanu vysoce reaktivní; z toho důvodu mohou být využity jako účinná paliva a výbušniny. Právě kombinace vysokého obsahu energie a toho, že kuban má ze všech uhlovodíků největší hustotu, může být využit jako palivo zaujímající malý prostor např. u letadel (prakticky se ale uhlovodíky s velikým pnutím dají kvůli ceně použít jen u křižujících střel apod.). Hledají se i uplatnění kubanu v lékařství a nanotechnologii.
Hlavní bariérou nasazení kubanu jako paliva a složky výbušnin je vysoká cena, která je v řádu stovek tisíc Kč/kg.
Syntéza
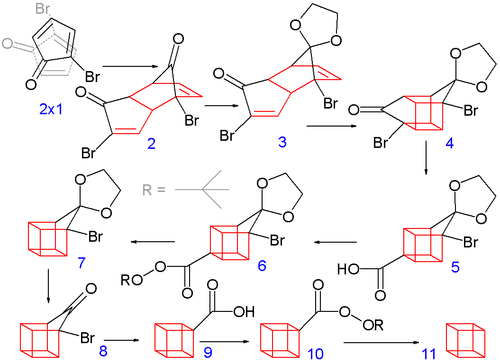
Původní syntéza z roku 1964 začíná u 2-cyklopentenonu (sloučenina 1.1 na reakci 1)[2][3]:
Reakcí s N v tetrachlormethanu se umístí na allylový zbytek atom bromu (obrázek 1.2) a další bromací bromem v pentanu - dichlormethanu vznikne tribromid (obrázek 1.3). Následně jsou ze sloučeniny působením diethylaminu v diethyleteru ze sloučeniny odštěpeny dva moly bromovodíku, čímž vznikne bromocyclopentadienon (obrázek 1.4).
Druhá část reakce začíná spontánní Dielsovou–Alderovou dimerizací (obrázek 2.2), která je analogická dimerizaci cydlopentadienu na dicyklopentadien. Aby byly další kroky úspěšné, měl by vznikat pouze endo izomer. To se skutečně děje, protože atomy bromu se snaží zaujmout pozici co nejdále od sebe navzájem i od karbonylové skupiny. Tímto způsobem jsou minimalizovány dipólové interakce během přechodného stavu reakce. Obě karbonylové skupiny jsou chráněny jako acetaly s ethylenglykolem a P-toluensulfonovou kyselinou v benzenu. Jeden acetal je selektivně uvolněn kyselinou chlorovodíkovou (obrázek 2.3).
V dalším kroku se z endoizomeru 2.3, který má obě alkenové skupiny v těsné blízkosti, se fotochemickou [2+2] cykloadicí vytváří kleci podobný izomer 2.4. Bromketonová skupina je konvertována na kruh uzavírající karboxylovou skupinu (obrázek 2.5) během Favorského přesmyku s hydroxidem draselným. Následuje tepelná dekarboxylace probíhající přes acyl chlorid (s thionyl chloridem) a přes terciární butyl organického peroxidu (obrázek 2.6 a 2.7), posléze je znovu odštěpen acetal (obrázek 2.8). Nakonec proběhne druhý Favorského přesmyk (obrázek 2.9) a zbývající dekarboxylace.
Anorganické krychle a odpovídající deriváty
Molekuly tvaru krychle se vyskytují i mimo oblast zájmu organické chemie. Běžně se vyskytující anorganické krychle jsou shluky [Fe4-S4], které se nalézají ve FeS proteinech, alternativně se mohou vyskytovat i jako čtyřstěny.
Některé organokovové sloučeniny mohou přijmou kubickou strukturu, např. (cyklopentadienylFe)4(CO)4, (pentamethylcyklopentadienylRu)4Cl4 a (trifenylfosfinAg)4I4,
Reakce
Kuneany mohou vznikat z kubanů pomocí σ-vazebného přesmyku katalyzovaného kovovými ionty. [4] [5]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Cubane na anglické Wikipedii.
- ↑ According to page 41 of a 2004 IUPAC guide Archivováno 17. 12. 2008 na Wayback Machine., cubane is the "preferred IUPAC name."
- ↑ a b EATON, Philip E.; COLE, Thomas W. Cubane. S. 3157–3158. Journal of the American Chemical Society [online]. 1964-08-01 [cit. 2020-11-23]. Roč. 86, čís. 15, s. 3157–3158. DOI 10.1021/ja01069a041. (anglicky)
- ↑ EATON, Philip E.; COLE, Thomas W. The Cubane System. S. 962–964. Journal of the American Chemical Society [online]. 1964-03-01 [cit. 2020-11-23]. Roč. 86, čís. 5, s. 962–964. DOI 10.1021/ja01059a072. (anglicky)
- ↑ Michael B. Smith, Jerry March, March’s Advanced Organic Chemistry, 5 th Ed., John Wiley & Sons, Inc., 2001, p. 1459. ISBN 0-471-58589-0
- ↑ K. Kindler, K. Lührs, Chem. Ber., vol. 99, 1966, p. 227.
Externí odkazy
 Obrázky, zvuky či videa k tématu Kuban na Wikimedia Commons
Obrázky, zvuky či videa k tématu Kuban na Wikimedia Commons - (anglicky)Eaton Cubane Synthesis @ SynArchive.com
- (anglicky)Cubane chemistry at Imperial College London
Média použitá na této stránce
Autor: V8rik na projektu Wikipedie v jazyce angličtina, Licence: CC BY-SA 3.0
Cubane Synthesis Precursor.
Ball-and-stick model of the cubane molecule.
Image generated in Accelrys DS Visualizer.