Kupferron
| Kupferron | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
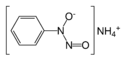
| Systematický název | N-nitrosofenylhydroxylamin amonný |
| Sumární vzorec | C6H9N3O2 |
| Vzhled | světle žluté až hnědé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 135-20-6 |
| EC-no (EINECS/ELINCS/NLP) | 205-183-2 |
| PubChem | 2724103 |
| SMILES | O=NN([O-])c1ccccc1.[NH4+] |
| InChI | 1S/C6H5N2O2.H3N/c9-7-8(10)6-4-2-1-3-5-6;/h1-5H;1H3/q-1;/p+1 |
| Vlastnosti | |
| Molární hmotnost | 155,15 g/mol |
| Teplota tání | 163,5 °C (436,6 K)[1] |
| Rozpustnost ve vodě | rozpustný[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu a dimethylsulfoxidu[1] |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H301 H315 H319 H335 H351[1] |
| P-věty | P201 P202 P261 P264 P270 P271 P280 P281 P301+310 P302+352 P304+340 P305+351+338 P308+313 P312 P321 P330 P332+313 P337+313 P362 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Kupferron je označení soli konjugované zásady N-nitroso-N-fenylhydroxylaminu (NH4[C6H5N(O)NO]). Používal se jako činidlo ke komplexaci kovových iontů v kvalitativní analýze. Anion se váže na kationty kovů přes dva atomy kyslíku za vzniku pětičlenných chelátových cyklů.
Příprava a tvorba komplexů
Kupferron se připravuje z fenylhydroxylaminu a zdroje NO+:[2]
- C6H5NHOH + C4H9ONO + NH3 → NH4[C6H5N(O)NO] + C4H9OH
Jako bidentátní monoaniontový ligand vytváří CU− podobné komplexy jako acetylacetonát. Příklady komplexů jsou Cu(CU)2, Fe(CU)3 a Zr(CU)4.[3][4][5]
Odkazy
Externí odkazy
 Obrázky, zvuky či videa k tématu Kupferron na Wikimedia Commons
Obrázky, zvuky či videa k tématu Kupferron na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Cupferron na anglické Wikipedii.
- ↑ a b c d e f g h Cupferron. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ C. S. Marvel. Cupferron. Organic Syntheses. 1925, s. 19. DOI 10.15227/orgsyn.004.0019.
- ↑ Y. Elerman; O. Atakol; I. Svoboda; M. Geselle. Bis(cupferronato)copper(II), [Cu(C6H5N2O2)2]. Acta Crystallographica Section C Crystal Structure Communications. 1995, s. 1520–1522. DOI 10.1107/S0108270195002770.
- ↑ D. Van Der Helm; L. L. Merritt; R. Degeilh; MacGillavry. The crystal structure of iron cupferron Fe(O2N2C6H5)3. Acta Crystallographica. 1965, s. 355–362. DOI 10.1107/S0365110X65000816.
- ↑ Wanda Mark; Ulf Aava; A. Haaland; Dag Resser; S. E. Rasmussen; Erling Sunde; Sørensen. The Crystal Structure of Zirconium Cupferrate, Zr(C6H5N2O2)4. Acta Chemica Scandinavica. 1970, s. 1398–1414. DOI 10.3891/acta.chem.scand.24-1398.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.