Kuwadžimova totální syntéza taxolu
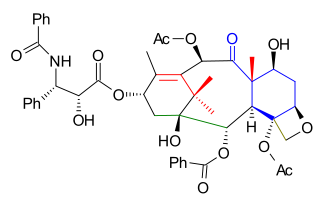
Kuwadžimova totální syntéza taxolu je jedním z postupů totální syntézy taxolu, vyvinula ji skupina, kterou vedl Isao Kuwadžima.[1][2]
Jedná se o plně syntetický postup bez využití malých biomolekul jako prekurzorů a také o lineární syntézu; jednotlivé kruhy v molekule se vytvářejí v pořadí A, B, C, D. V určité části je do molekuly zavedena chiralita asymetrickým krokem, jedinečným oproti jiným postupům. Podobně jako u řady jiných metod se vedlejší řetězec navazuje prostřednictvím Odžimova laktamu.
20uhlíkatý řetězec je zde vytvořen z několika sloučenin: propargylalkoholu (C1, C2, C14), propionaldehydu (C13, C12, C18), kyseliny isomáselné (C15, C16, C17, C11), trimethyl(fenylthiomethyl)silanu (C10), 2-brombenzaldehydu (C3 až C9), diethylaluminumkyanidu (C19) a trimethylsilylmethylbromidu (C20)
Syntéza kruhu A
Syntéza kruhu A (viz obrázek 1) začala spojením propargylalkoholu chráněného tetrahydropyranem (THP) 1.1 a propionaldehydu 1.2 nukleofilní adicí pomocí n-butyllithia za vzniku alkoholu 1.3. Za přítomnosti Lindlarova katalyzátoru poté proběhla redukce alkynové skupiny na alken 1.4 a Swernova oxidace, vedoucí k přeměně alkoholu na enon 1.5. Následně byl navázán fragment C11-C15-C16-C17 1.6 jako lithný enolát ethylesteru kyseliny isomáselné v konjugované adici za vzniku gama-ketoesteru 1.7. Claisenovou kondenzací se uzavřel kruh za tvorby 1.8 a na enolový meziprodukt byl navázán pivaloylchlorid (piv), sloužící jako chránicí skupina. Následně byla odstraněna THP skupina prostřednictvím kyseliny p-toluensulfonové za tvorby sloučeniny 1.9; tento alkohol se poté Swernovou oxidací převedl na aldehyd 1.10. Následně vznikl triisopropylsilylenolether 1.11 reakcí s triisoproipylsilyltriflátem (TIPSOtf) a 1,8-diazabicyklo[5.4.0]undec-7-enem (DBU) v 4-dimethylaminopyridinu (DMAP), po čemž následovala Sharplessova asymetrická dihydroxylace na hydroxyaldehyd 1.12. Pivaloylová chránicí skupina byla následně nahrazena triisopropylsilylovou za vzniku 1.14 po ochránění aldehydu jako aminalu 1.13; tato skupina se odštěpila při provádění sloupcové chromatografie, krok byl poté opakován za účelem vytvoření aminalu 1.15. Poté se zavedl C10 fragment pomocí lithné soli trimethyl(fenylthiomethyl)silan 1.16 Petersonovou reakcí, což vedlo k tvorbě thioetheru 1.17, ze kterého se po odstranění chránicích skupin stal kruh A 1.18, obsahující aldehydovou a thioetherovou skupinu v místech pro napojení kruhu C a tvorby kruhu B.
 |
| Obrázek 1 |
|---|
Syntéza kruhu B
Spodní část kruhu B byla vytvořena nukleofilní adiční reakcí aldehydu 2.1 (viz obrázek 2) s dibenzylacetalem 2-brombenzaldehydu 2.2 za přítomnosti fenyllithia. Tento krok se podobá tvorbě kruhu B u Nicolaouovy syntézy, aldehydová skupina se jen nachází na kruhu A a ne na B. Diol u 2.3 byl ochráněn jako ester boronové kyseliny 2.4, což umožnilo uzavření horní části kruhu pomocí chloridu cíničitého za vzniku tricyklického meziproduktu 2.5 reakcí podobnou Grobově fragmentaci.
Po odstranění chránicí skupiny působením pinakolu se utvořil diol 2.6, redukcí diisobutylaluminiumhydridem (DIBAL) vznikl triol 2.7 a opětovné navázání TBS (TBSOtf a lutidinem) vedlo k alkoholu 2.8 Fenylsulfidová skupina byla odvázaná působením tributylcínhydridu a azobisisobutyronitrilu (šlo o Bartonovu–McCombieovu deoxygenaci) a vytvořil se alkohol 2.9. hydrogenací katalyzovanou palladiem na uhlíku se odštěpila benzylová skupina, což umožnilo Swernovu oxidaci sloučeniny 2.10 na keton 2.11
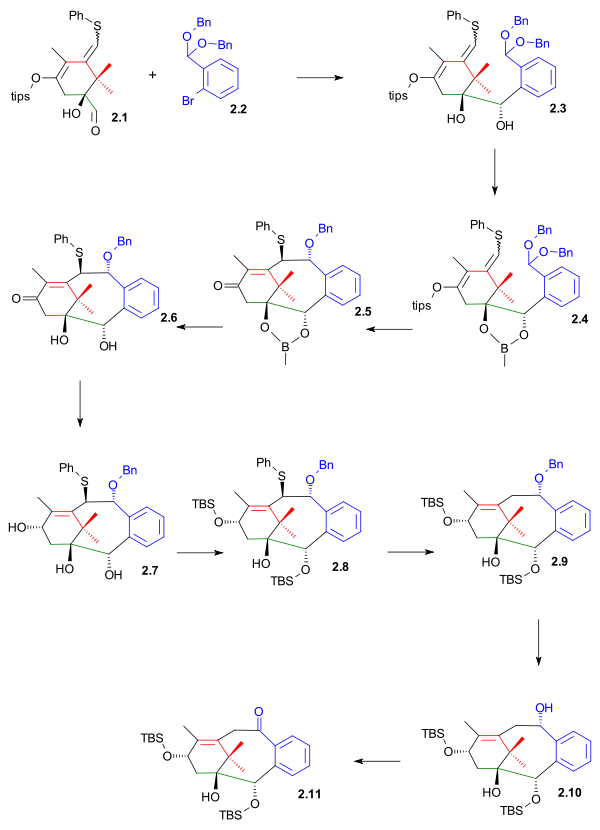 |
| Obrázek 2 |
|---|
Syntéza kruhu C
Vytvoření kruhu C vyžadovalo úplnou redukci arenu, umístění kyslíkových atomů do poloh para a zavedení C19 methylové skupiny. Prvním krokem u aromatické sloučeniny 3.1 (viz obrázek 3) byla Birchova redukce (draslíkem v amoniaku a tetrahydrofuranu (při −78 °C) a následným působením ethanolu) na dien 3.2. Odstranění chránicí skupiny tetra-n-butylamoniumfluoridem za vzniku diolu 3.3, zpětná ochrana v podobě acetalu benzaldehydu 3.4 a redukce tetrahydridoboritanem sodným na alkohol 3.5 umožnily oxidaci dienu na buten-1,4-diol 3.6. V této fotochemické [4+2] cykloadici se z kyslíku vytvořil singletový kyslík a peroxid se zredukoval thiomočovinou. Dále bylo potřeba navázat C19 fragment: nově vzniklý diol byl ochráněn jako p-methoxyfenylacetal 3.7 a došlo k oxidaci C4 alkoholu na keton 3.8 Dessovým–Martinovým perjodinanem. S enonovou skupinou následně reagoval diethylaluminumkyanid v konjugované adici za vzniku nitrilu 3.9. Enol byl ochráněn jako tributylsilylether 3.10 a následně proběhla redukce nitrilu, nejprve diisobutylaluminiumhydridem na aldehyd a poté hydrodiem lithnohlinitým na alkohol 3.11. Alkoholová skupina byla pomocí Appelovy reakce nahrazena bromem, což vedlo k odštěpení HBr a tvorbě derivátu cyklopropanu 3.12; působením kyseliny chlorovodíkové se následně vytvořil keton 3.13, jenž po otevření kruhu reakcí s jodidem samarnatým umožnil navázání C19 methylu 3.14 a poté odštěpením TBS pomocí tetra-n-butylamoniumfluoridu a následné přeměně enolu na keton vznikl hydroxyketon 3.15
 |
| Obrázek 3 |
|---|
Syntéza kruhu D
Po ochránění diolové skupiny triolu 4.1 (viz obrázek 4) jako fenylboronového esteru 4.2 byla zbývající alkpoholová skuupina ochráněna jako TBS ether 4.3. Odvázáním chránicí skupiny z diolu peroxidem vodíku a hydrogenuhličitanem sodným 4.4 bylo možné zoxidovat alkoholovou skupinu na C19 na keton 4.5 Dessovým–Martinovým perjodinanem. Následně se C7 alkohol přeměnil na 2-methoxy-2-propylether 4.6 působením prop-2-enylmethyletheru a pyridinium-p-toluensulfonátu (PPTS) a C7 keton na enolát 4.7 reakcí s bis(trimethylsilyl)amidem draselným (KHMDS) a N,N-bis(trifluormethylsulfonyl)anilinem. Napojení chybějícího C20 fragmentu bylo provedeno s využitím reakce Grignardova činidla trimethylsilylmethylmagnesiumbromidu s triflátem za katalýzy tetrakis(trifenylfosfin)palladiem, jejímž produktem se stal silan 4.8. Odštěpení trimethylsilylové skupiny reakcí s N-bromsukcinimidem (NCS) dalo vzniknout organochloridu 4.9. Před uzavřením kruhu D bylo třeba provést úpravy na kruhu C. Na C10 byla vytvořena alkoholová skupina oxidací pomocí MoOPH na 4.10, ovšem s nesprávnou stereoizomerií. Po acetylaci za vzniku 4.11 a obrácení konfigurace za přítomnosti 1,5-diazabicyklo[4.3.0]non-5-enu (DBN) byla tato potíž vyřešena u sloučeniny 4.12. Následnou dihydroxylací oxidem osmičelým vznikl diol 4.13, z něhož byla přidáním primárního alkoholu za přítomnosti 1,8-diazabicyklo[5.4.0]undec-7-enu (DBU) odstraněna chloridová skupina nukleofilní substitucí za tvorby oxetanu 4.14.
 |
| Obrázek 4 |
|---|
Funkční skupiny C1, C2 a C4 byly vytvářeny počínaje oxetanem 5.1 (viz obrázek 5), ze kterého byla s použitím PPTS odstraněna MOM chránicí skupina za tvorby meziproduktu 5.2; na stejné místo se poté napojila triethylsilylová skupina pomocí triethylsilylchloridu, což vedlo ke sloučenině 5.3. Hydrogenací katalyzovanou hydroxidem palladnatým (PdOH2) se odštěpil acetal a vytvořil meziprodukt 5.4, po nahrazení acetalu karbonátem (za přítomnosti trifosgenu a pyridinu) vznikla sloučenina 5.5. Terciární alkoholová skupina prošla acetylací na 5.6 a poté byla otevřena karbonátová skupina reakcí s fenyllithiem a utvořil se hydroxyester 5.7.
Před navázáním tohoto řetězce byla kyselinou fluorovodíkovou v pyridinu odstraněna TES chránicí skupina, což vytvořilo 5.8 a po navázání TROC trichlorethylkarbonátem a TROCCl 5.9. U meziproduktu 5.10 byla odstraněna chránicí skupina z C13 alkoholu tris(dimethylamino)sulfoniumdifluortrimethylsilikátem (TASF), což umožnilo reakci s Odžimovým laktamem 5.11 (tento krok obsahují všechny známé syntézy taxolu) za přítomnosti bis(trimethylsilyl)amidu lithného a tvorby 5.12. K dokončení syntézy a vzniku taxolu 5.13 bylo ještě potřeba odstranit TROC chránicí skupinu, k čemuž posloužily zinek a kyselina octová.
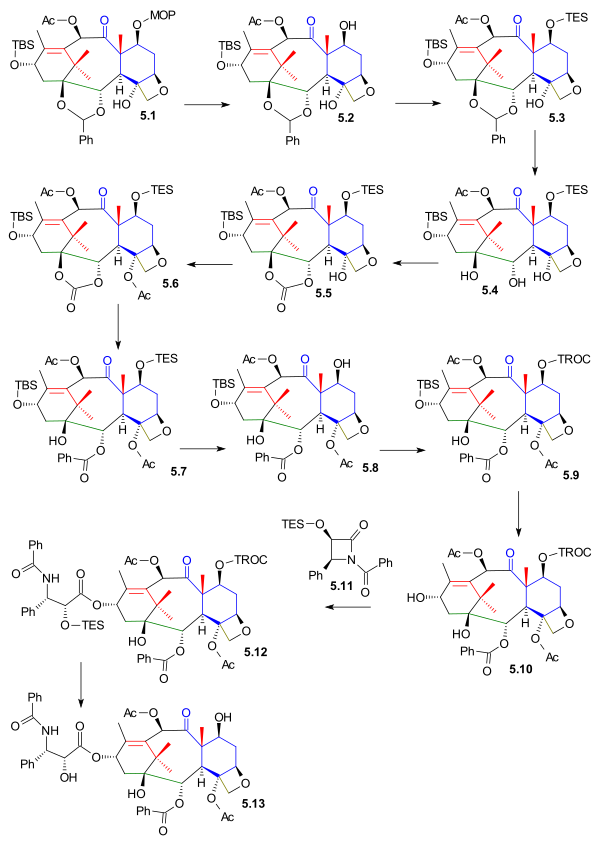 |
| Obrázek 5 |
|---|
Odkazy
Související články
- Totální syntéza taxolu
- Danishefského totální syntéza taxolu
- Holtonova totální syntéza taxolu
- Mukaijamova totální syntéza taxolu
- Nicolaouova totální syntéza taxolu
- Wenderova totální syntéza taxolu
- Takahašiova totální syntéza taxolu
Externí odkazy
Reference
V tomto článku byl použit překlad textu z článku Kuwajima Taxol total synthesis na anglické Wikipedii.
- ↑ Koichiro Morihira; Shigeru Kawahara; Toshiyuki Nishimori; Nobuhito Nakamura; Hiroyuki Kusama; Isao Kuwajima. Enantioselective Total Synthesis of Taxol. Journal of the American Chemical Society. 1998, s. 12980–12981. DOI 10.1021/ja9824932.
- ↑ Hiroyuki Kusama, Ryoma Hara, Shigeru Kawahara, Toshiyuki Nishimori, Hajime Kashima, Nobuhito Nakamura, Koichiro Morihira, Isao Kuwajima. Enantioselective Total Synthesis of (−)-Taxol. Journal of the American Chemical Society. 2000, s. 3811–3820. DOI 10.1021/ja9939439.
Média použitá na této stránce
Autor: Dissolution, Licence: CC BY-SA 3.0
Kuwajima Taxol total synthesis part D
Autor: Dissolution, Licence: CC BY-SA 3.0
Kuwajima Taxol total synthesis part A
Autor: Dissolution, Licence: CC BY-SA 3.0
Kuwajima Taxol total synthesis part B
Autor: Dissolution, Licence: CC BY-SA 3.0
Kuwajima Taxol total synthesis overview
Autor: Dissolution, Licence: CC BY-SA 3.0
Kuwajima Taxol total synthesis part E
Autor: Dissolution, Licence: CC BY-SA 3.0
Kuwajima Taxol total synthesis part C





